Details zur ersten klinischen Studie einer Gentherapie gegen die Huntington-Krankheit
UniQure gibt Eckdaten zur geplanten Studie der Sicherheit und Verträglichkeit einer Gentherapie mit AMT-130 bekannt. Die Menge an Huntingtin-Eiweiß soll mit einer einzigen Behandlung mit einem Virussystem reduziert werden.
Von Dr Anna Pfalzer 21. Juli 2019 Bearbeitet von Professor Ed Wild Übersetzt von Rebecca Ursprünglich veröffentlicht am 17. Juli 2019
Kürzlich bei der jährlichen Huntington’s Disease Society of America Versammlung in Boston, gab UniQure grundlegende Eckpunkte der geplanten klinischen Studie zur Therapie mit AMT-130 bekannt. Wir haben bereits früher über das Medikament AMT-130 berichtet, und möchten in diesem Artikel einige Grundlagen aufgreifen sowie die Neuigkeiten der letzten Tage.
Huntingtin-Verminderung mithilfe von Gentherapie
AMT-130 ist ein Medikament zur Huntingtin-Reduzierung, da es die Produktion des Huntingtin-Eiweißes und dessen schädliche Auswirkungen auf Neuronen im Laufe der Huntington-Krankheit, vermindern soll.

Es gibt allerdings einen wichtigen Unterschied zwischen AMT-130 und den sogenannten Antisense-Oligonukleotiden (ASOs), über die wir zuletzt im Rahmen der Studien von Roche und Wave Life Sciences berichteten.
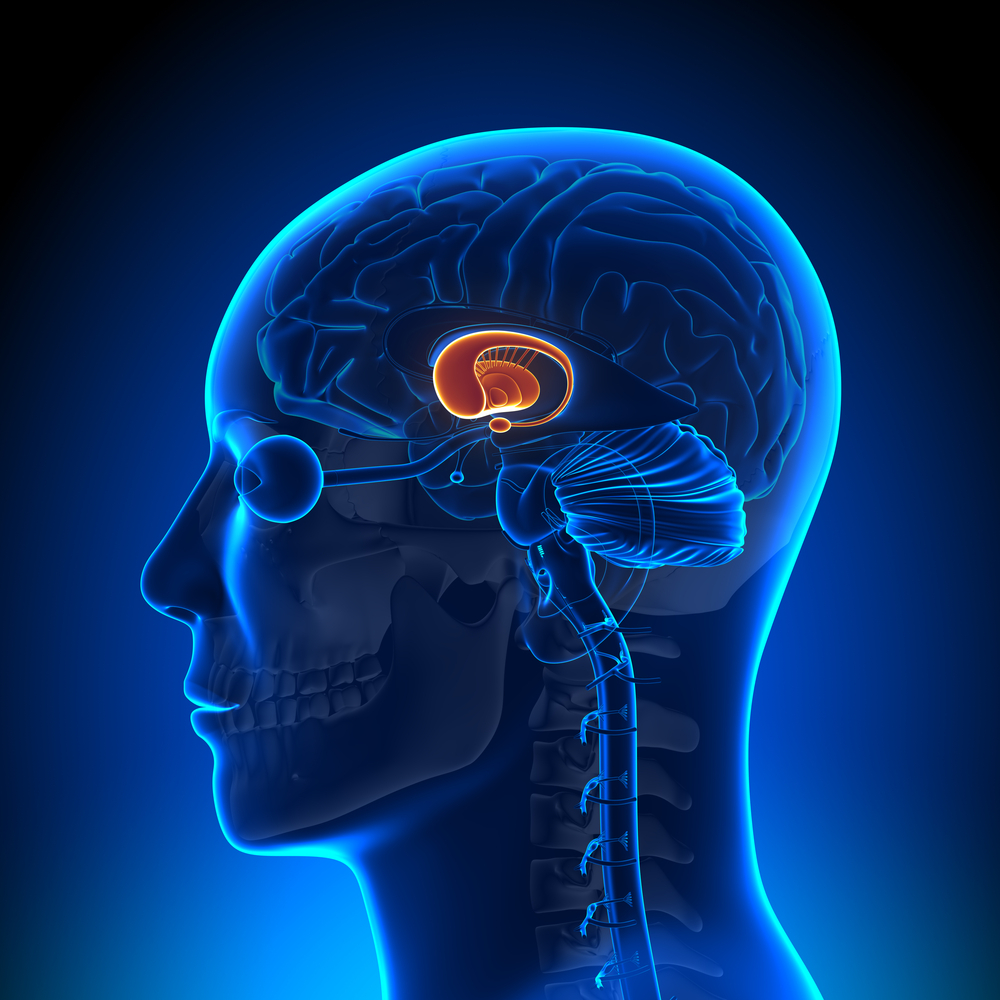
AMT-130 stellt nämlich eine Gentherapie dar. Es handelt sich um eine permanente Veränderung der genetischen Substanz des behandelten Patienten. Zwar soll AMT-130 die Huntington-Mutation nicht vollständig aus dem Gen löschen, das wäre eine höchst komplexe Angelegenheit. Aber AMT-130 fügt mithilfe eines harmlosen adeno-assozierten Virus (AAV) einen kleinen Extra-Gencode in den Zellen hinzu.
Sobald ein Neuron mit AMT-130 behandelt wird, wird es kontinuierlich ein neues Huntingtin-abbauendes Molekül erzeugen. Obwohl das schädliche Huntington-Gen also unverändert in den Neuronen vorhanden ist, und weiterhin Anweisungen von ihm ausgesendet werden, das Eiweiß Huntingtin herzustellen, wird gleichzeitig auch die Anleitung vorhanden sein, genau diese Anweisung - in Form der mRNA - zu löschen. Daraus sollte eine verminderte Produktion von Huntingtin resultieren und das über einen langen Zeitraum hinweg - potentiell lebenslang.
Was ist mit der Studie?
UniQure verkündete einige vorläufige aber wichtige Details zur geplanten Studie in einer Stellungnahme an die Huntington-Gemeinschaft. Im Folgenden lesesn Sie, was wir bisher wissen.
Der Fokus der ersten Studie wird auf Sicherheit und Verträglichkeit liegen - gibt es eventuell irgendwelche schädlichen oder unerwünschten Nebenwirkungen nach der Behandlung mit AMT-130.
UniQure schließt aber auch die Wirksamkeit in die Ziele der Studie mit ein: das bedeutet man wird eine Vorstellung davon bekommen, ob die Behandlung das tut, was man von ihr erwartet. Schlussendlich wird eine Verlangsamung der des Krankheitsverlaufes erwartet. Es ist theoretisch möglich, aber sehr unwahrscheinlich, dass eine solche Verlangsamung innerhalb dieser ersten kurzen Studie beobachtet werden kann. Daher setzt man sich das erreichbarere Ziel der Reduzierung von Huntingtin, das mithilfe einiger von uns zuvor beschriebener Methoden gemessen werden kann.
Die AMT-130-Studie wird an Studienzentren in den USA durchgeführt. Wir wissen noch nicht, welche genau oder wie viele es sein werden. Sie werden wohl im Laufe des Jahres öffentlich verkündet. UniQure hofft, vor Ende 2019 die ersten Patienten aufnehmen zu können.
Es sollen nur 26 Patient/-innen mit frühen Symptomen der Huntington-Krankheit teilnehmen. Das heißt, es sind Menschen mit Bewegungsauffälligkeiten innerhalb der ersten paar Jahre, nachdem die Krankheit durch einen Neurologen bei ihnen diagnostiziert wurde. Die Altersvorgabe reicht von 25 bis 65 Jahren.
Was ungewöhnlich ist, ist dass uniQure eine Untergrenze von 44 CAG-Repeats gesetzt hat. Etwa 50% der Betroffenen mit einem positiven Gentest für die Huntington-Krankheit weisen zwischen 40 und 45 CAG-Wiederholungen auf. Dadurch wird also die Einzugsgruppe für die Studie sehr eingeschränkt. Es könnte sein, dass uniQure diese Vorgabe allerdings macht, um möglichst solche Teilnehmenden zu haben, bei denen die Krankheit wahrscheinlich schnell voranschreitet. In diesen Fällen sollte es nämlich auch leichter sein, einen positiven Effekt durch die Behandlung mit AMT-130 zu zeigen.
Die 26 Teilnehmenden werden zufällig in zwei Gruppen aufgeteilt werden. 16 Personen werden die “aktive” Gruppe bilden. Sie werden AMT-130 entweder in niedriger oder in höherer Dosis erhalten. Zehn erhalten eine “Imitationsbehandlung”, das was mir meistens als Placebo kennen.
Der große Vorteil, auf den man bei der Behandlung mit AMT-130 hofft, ist die einmalige Anwendung, allerdings hat es diese in sich. Es handelt sich um eine Operation am Gehirn unter Vollnarkose. Zwischen zwei und sechs kleinen Löchern werden in den Schädel gebohrt, um dünne Röhrchen namens Katheter hindurchzuführen. Die AMT-130-Mischung wird über diese Kanäle in das Gehirn injiziert.
Bei Patienten/-innen der Placebo-Gruppe erhalten in diesem Fall zwar ebenfalls eine Vollnarkose und es werden auch flache Mulden in ihren Schädel gebohrt, die aber nicht durchgängig sind. Bei ihnen werden keine Katheter verlegt und es wird keine Injektion verabreicht. Daher Imitationsbehandlung.
Der Zweck dieses Vorgehens ist es, zu zeigen, ob die Auswirkungen der Studie - positiv oder negativ - von der Behandlung mit AMT-130 ausgehen oder vom Placebo-Effekt (dem psychologischen Schub durch die Teilnahme an einer klinischen Studie). Oder ob sie durch die Anästhesie und die Operation ausgelöst werden.
Die Teilnehmenden werden über 18 Monate hinweg intensiv beobachtet werden. Dazu werden Untersuchungen wie MRT und Lumbalpunktionen durchgeführt. Im Anschluss sollen Patienten aus der aktiven Gruppe noch für weitere 5 Jahre zu jährlichen Untersuchungen erscheinen.
Das OP-Team wird wissen, welcher Patient in welcher Gruppe ist, aber die Teilnehmenden selbst und das restliche Fachpersonal werden es nicht wissen. Die Studie ist also doppel-blind, sodass der Placebo-Effekt die Ergebnisse so wenig wie möglich beeinträchtigt und das Ziel der Studie, die Wirksamkeit des Medikamentes nachzuweisen, ermöglicht wird.
Die Imitationsgruppe wird nach Abschluss der Studie das Angebot bekommen, eine vollwertige Behandlung mit AMT-130 zu erhalten.
Risiko und Belohnung
Der größte potentielle Vorteil von AMT-130 ist gleichzeitig sein größter potentieller Pferdefuß. Es handelt sich um eine Gentherapie, eine einzige Behandlung mit dauerhaften Folgen.
Wenn alles funktioniert wie geplant, könnte es eine Heilmethode sein, die früh nach einem positiven Gentest angewendet werden könnte und dann lange, vielleicht sogar lebenslang, Schutz bietet. Sie könnte den Fortschrtt der Krankheit verlangsamen oder sogar deren Ausbruch verschieben, ohne dass wiederkehrende Behandlungen nötig wären.
Jedoch könnten auf der anderen Seite im Falle, dass Nebenwirkungen auftreten, auch diese ungewollten Effekte lange anhalten - und bisher ist kein Gegenmittel bekannt, sobald das Medikament einmal verabreicht wurde. Wir machen ein fiktives Beispiel: Wenn zum Beispiel die Behandlung aus irgendwelchen Gründen zu einer Verschlechterung der Bewegungen führt oder einer Beschleunigung der Krankheit allgemein oder dauerhafte Übelkeit auslöst? Es könnten bleibende Schäden oder gar Behinderungen ausgelöst werden. Die Ärzte würden alles tun, um das wieder in den Griff zu bekommen, aber die Behandlung kann nunmal nicht rückgängig gemacht werden.
Desweiteren ist es wichtig zu beachten, dass AMT-130 darauf ausgelegt ist, die Menge beider Versionen des Huntingtin-Eiweißes zu verringern. Es wird also nicht nur die Produktion des schädlichen, mutierten Huntingtins verhindert, sondern auch die des “normalen” oder “wilden” Typs. Es gibt Bedenken, dass weniger wildes Huntingtin negative Folgen haben könnte, die möglicherweise sogar den Vorteil der Reduzierung des mutierten Typs vereiteln. Diese Bedenken gründen sich hauptsächlich auf Experimente an Mäusen. Bisher sind die Effekte bei Menschen - die sich von Mäusen stark unterscheiden - noch unbekannt. Wichtige Hinweise wird man hoffentlich bald aus zwei laufenden Huntingtin-Verminderungs-Studien erhalten, bei denen Medikamente in das Nervenwasser gegeben werden: Roche’s RG6042, bei dem beide Typen des Proteins verringert werden sollen und Wave’s Precision-HD-Programm, bei dem gezielt nur der mutierte Typ reduziert werden soll.
AMT-130 wurde an Tieren getestet und hätte keine Erlaubnis für eine Studie am Menschen erhalten, wenn unannehmbare Risiken entdeckt worden wären. Aber letztendlich kann nur durch die Studie am Menschen gezeigt werden, welche Linderungen und Schäden sich ergeben. Zusätzlich zum Risiko einer Gehirnoperation, können sich die Freiwilligen, die an der Studie teilnehmen möchten, darauf einstellen ausführlich über jene weiteren Risiken aufgeklärt zu werden, ohne dass man ihnen eine Garantie geben könnte, dass sie gleichzeitig einen persönlichen Vorteil haben. Es werden von diesen Freiwilligen also große persönliche Opfer zum Wohle der Allgemeinheit gefordert - sie sind damit mit ihrer Teilnahme einer humanen Erststudie unter den größten individuellen Helden der Huntington-Gemeinschaft.
Ein wichtiger Fortschritt
Für uns bei HDBuzz gibt es einen Lieblingscocktail namens substanstielle Hoffnung. Er besteht zu gleichen Teilen aus Optimismus und Realismus. Nach unseren vorherigen Berichten über Huntingtin-Verminderungs-Therapien, gab man uns einige Rückmeldungen, die besagten, wir seien zu positiv und wiederum andere sagten, wir seien zu negativ (man hat uns gesagt, wir sollten uns in “HDBuzzKill” umbenennen, weil wir Hoffnungen zerstören). Die Wahrheit liegt wohl dazwischen und wir hoffen, dass das bedeutet, dass wir eigentlich ungefähr realistisch liegen - aber das können Sie selbst entscheiden.
Wir ermutigen alle unsere Leser, sich ihre Informationen möglichst aus mehreren Quellen zusammenzusuchen. Dazu haben wir im Jahr 2011 einen Artikel geschrieben, der dabei helfen soll, offen für neue Ideen zu sein und dabei gleichzeitig eine gesunde Skepsis gegenüber jeglichem Hype zu bewahren. Wir schämen uns nicht dafür, die Huntington-Familienmitglieder zu unterstützen, die freiwillig an wissenschaftlichen Studien teilnehmen: dabei handelt es sich um die einzige Art und Weise, auf die man wirkliche Fortschritte im Kampf gegen die Huntington-Krankheit machen kann. Dennoch raten wir allen, die darüber nachdenken, an einer Studie teilzunehmen, die Risiken genauso wie die Vorteile abzuwägen und Rat bei Fachärzten ihres Vertrauens zu suchen.
Unsere Sicht auf AMT-130: die erste Huntingtin-Verminderungs-Gentherapie in einer menschlichen Studie hat das Potential, den Weg für eine neue Generation völlig revolutionärer Medikamente zu bahnen. In unseren Augen sind diejenigen, die freiwillig teilnehmen, genauso mutig wie die Astronauten, die vor 50 Jahren die ersten Schritte auf dem Mond machten. Unter bedeutendem persönlichen Risiko werden sie einen gar nicht mal so kleinen Schritt ins Ungewisse tun, in der Hoffnung, einen großen Sprung für die Huntington-Familien zu erreichen.
Wir werden im Laufe deren Entwicklung weiterhin Neuigkeiten zu dieser und anderen Huntingtin-Verminderungstherapien veröffentlichen.


