Präzisionsstudien mit Huntingtin-senkenden Medikamenten zielen auf das mutierte Protein ab
WAVE Life Sciences startet die klinische PRECISION-Studie zur Unterdrückung des mutierten Huntington-Krankheitsproteins
Ein neues, aufregendes Kapitel in der Behandlung der Huntington-Krankheit (HD) beginnt gerade – WAVE Life Sciences hat PRECISION-HD1 und 2 angekündigt, klinische Studien mit zwei neuen Medikamenten, die das mutierte Huntington-Krankheitsprotein senken. Wir freuen uns über diesen neuartigen Ansatz zur Huntingtin-Senkung, aber dies sind frühe Tage und wir haben noch einen langen Weg vor uns, um zu zeigen, dass sie bei Menschen sicher und wirksam sind.
Warum versuchen wir, die Menge an Huntingtin-Protein zu senken?
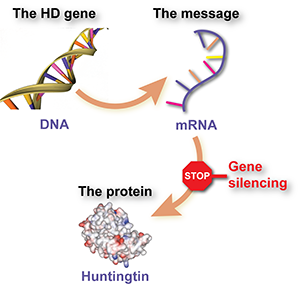
Wenn Gene die Bedienungsanleitung sind, die unsere Zellen verwenden, um unseren Körper herzustellen, dann ist DNA die Sprache, in der die Anleitung geschrieben ist. Jedes Kapitel stellt ein anderes Protein her, und es sind diese Tausenden von verschiedenen Proteinen, die alle Zellen unseres Körpers ausmachen. Offiziell heißt das HD-Gen HTT und das Protein, dessen Anweisungen es enthält, Huntingtin.

Bildnachweis: Mike Flower
Menschen haben zwei Kopien des HTT-Gens. HD tritt auf, wenn eine Mutation eine Kopie zu groß macht. Das expandierte Protein, das von dieser mutierten Kopie des Gens hergestellt wird, ist giftig für unsere Zellen, insbesondere für die im Gehirn. Wir wissen, dass die Senkung des Spiegels des mutierten Huntingtin-Proteins in HD-Mausmodellen die Symptome, die an HD erinnern, deutlich verbessert, was Hoffnung gibt, dass ähnliche Behandlungen bei Menschen wirksam sein könnten.
Was ist Huntingtin-Senkung?
Auf die gleiche Weise, wie wir es mit vielen Antibiotika und Krebsmedikamenten getan haben, können wir einen der natürlichen Prozesse der Natur nutzen, um das Huntingtin-Protein zu unterdrücken. In diesem Fall ist es ein Mittel, mit dem Zellen ihre eigene DNA erhalten und kopieren.
Die DNA, die sich in unseren Zellen befindet, besteht normalerweise aus zwei miteinander verflochtenen DNA-Strängen, die in der bekannten Doppelhelix-Form umeinander gewickelt sind. Diese gepaarten Stränge ermöglichen es der Zelle, ihre DNA zu replizieren oder zu kopieren, indem sie jeden Strang auseinanderzieht und ihn als Vorlage für eine neue Kopie verwendet. An verschiedenen Stellen in diesem Prozess verwenden Zellen RNA als eine Art Gerüst, um die DNA zu replizieren. Wenn das Kopieren abgeschlossen ist, müssen diese Gerüste entfernt werden, sodass Zellen sehr effizient darin geworden sind, RNA- und DNA-Stücke, die miteinander verbunden sind, abzubauen.
Zellen verwenden RNA für einen anderen Zweck, nämlich um genetische Botschaften in den Zellen zu transportieren. Wenn eine Zelle ein bestimmtes Protein benötigt – sagen wir, das Huntingtin-Protein – um ihre Funktion auszuführen, wird eine Anfrage an die DNA-Manager der Zellen gesendet. DNA ist kostbar – wenn wir unsere DNA durcheinander bringen, bekommen wir Krebs oder sterben – also erstellen die zellulären Manager der DNA eine Kopie des angeforderten Gens. Die Kopie wird nicht in DNA, sondern in der Sprache der RNA erstellt. Diese RNA-Botschaft – genannt mRNA – wird von den Produktionsstätten der Zellen verwendet, um mehr Huntingtin-Protein zu erzeugen.
Diese intermediäre mRNA, die Informationen zwischen DNA und Protein herstellenden Maschinen transportiert, ist das Ziel von Huntingtin-senkenden Medikamenten. Das Ziel dieser Medikamente ist es, diese Botschaft auf verschiedene Weise zu zerstören und den Protein herstellenden Maschinen der Zelle die Anweisungen zur Herstellung eines bestimmten Proteins zu verweigern.
Was hat das mit HD zu tun? Hier kommen Antisense-Oligonukleotide oder ‚ASOs‘ ins Spiel. ASOs kommen nicht natürlich vor, sondern werden von Wissenschaftlern hergestellt, um die Zelle dazu zu bringen, ein bestimmtes Messenger-RNA-Molekül zu zerstören. Im Wesentlichen ähneln ASOs kurzen DNA-Abschnitten, die so modifiziert wurden, dass sie in Zellen eindringen können. Einmal drin, haftet das ASO an einer bestimmten Sequenz, die nur in der Messenger-RNA des HD-Gens vorkommt.
Erinnern Sie sich an die Gerüste zum Kopieren von DNA und wie sie aufgeräumt werden? Wenn Zellen einen DNA-Abschnitt (das ASO in diesem Fall) sehen, der an einem RNA-Stück (die HD-Botschaft) klebt, denken sie, es sei ein Stück Gerüst, das übrig geblieben ist, und zerstören es. Voila, wir haben eine Zelle dazu gebracht, nur eines der vielen Zehntausend RNA-Moleküle zu zerstören, die sich in dieser Zelle befinden.
Eine große Herausforderung besteht darin, diese hergestellten ASOs ins Gehirn zu bekommen, weil sie nicht durch die Wände der Blutgefäße in unserem Gehirn gelangen können. Wir konnten dies umgehen, indem wir sie direkt in die Zerebrospinalflüssigkeit (CSF) injizierten, die Flüssigkeit, die das Gehirn und das Rückenmark umgibt und polstert. Von dort werden die ASOs in Gehirnzellen aufgenommen, wo sie ihr Zielprotein für etwa einen Monat weiterhin unterdrücken, danach muss mehr injiziert werden.
Wie unterscheidet sich dies von der laufenden ASO-Studie?
Ionis Pharmaceuticals steht kurz vor dem Ende einer aufregenden klinischen Studie mit einem ASO, das auf die Huntingtin-RNA abzielt. Das Ionis-ASO unterscheidet nicht zwischen RNA, die von der normalen und der mutierten Kopie des Gens stammt, sodass es die Menge sowohl des normalen als auch des mutierten Proteins senkt. Dies ist einer der Gründe, warum wir mit dieser Behandlung so vorsichtig vorgehen – die Senkung der Menge an normalem Protein mag zwar sicher sein, könnte aber langfristig auch schädlich sein. Wir wissen, dass das normale Protein für die Entwicklung eines Babys sehr wichtig ist. Studien an mehreren Tieren haben jedoch gezeigt, dass die teilweise Unterdrückung sowohl der normalen als auch der mutierten Version um etwa 50 % bei Erwachsenen sicher ist und die Symptome verbessert.
Was WAVE getan hat, könnte diese Probleme umgehen, da ihre beiden Medikamente speziell auf das mutierte Gen abzielen und die normale Kopie in Ruhe lassen. Sie tun dies, indem sie auf kleine genetische Unterschiede in der DNA abzielen, die als Einzelnukleotid-Polymorphismen oder ‚SNPs‘ (ausgesprochen ‚Snips‘) bezeichnet werden. Stellen Sie sich diese SNPs als verschiedenfarbige Bänder vor, die an einem Drachen hängen. Jeder mit HD lässt zwei Drachen steigen – einen ‚guten‘ und einen ’schlechten‘. Stellen Sie sich das ASO als eine Drohne vor, die den schlechten Drachen abschießen will. Leider kann die Drohne nicht zwischen den Drachen selbst unterscheiden. Sie kann jedoch die verschiedenfarbigen Bänder am Schwanz erkennen, und auf das Band zu schießen, anstatt auf den Drachen, ist genauso gut, um das Ganze zu Fall zu bringen.
WAVE hat ASOs entwickelt, die auf zwei SNPs im HTT-Gen abzielen, weshalb sie zwei separate klinische Studien starten. Diese SNPs wurden ausgewählt, weil ihre Sequenzen tendenziell im normalen und mutierten HTT-Gen unterschiedlich sind: Die Bänder an dieser Stelle in den Schwänzen der guten und schlechten Drachen haben tendenziell eine andere Farbe, die von der Drohne unterschieden werden kann. An der Stelle des ersten SNP, der in der wissenschaftlichen Sprache ‚rs362307‘ genannt wird, haben die Hälfte der HD-Patienten verschiedenfarbige Bänder in ihren guten und schlechten Drachen. Für den zweiten SNP, ‚rs362331‘, gibt es bei 40 % der HD-Patienten verschiedenfarbige Bänder. Insgesamt sollten mindestens zwei Drittel der Menschen mit HD in Europa und den USA unterschiedliche Bänder haben, die es einem dieser Medikamente ermöglichen, den schlechten Drachen abzuschießen.
Leider bedeutet das, dass etwa ein Drittel der Menschen an diesen Stellen auf beiden, den guten und schlechten Drachen, die gleichen Bänder haben, sodass diese Medikamente nicht speziell auf das mutierte HTT-Gen abzielen würden. Sollten die Medikamente jedoch bei Menschen wirken, gäbe es einen starken Anreiz, die Entwicklung neuer ASOs, die auf andere Bänder abzielen, zu untersuchen.
Welche Beweise gibt es dafür, dass diese Medikamente wirken werden?
Diese Studien von WAVE sind etwas einzigartig, da das Unternehmen keine Studien in HD-Tiermodellen mit ihren spezifischen Medikamenten durchgeführt hat. Mäuse und andere von Forschern geliebte Tiere haben ebenfalls zwei Kopien des HD-Gens. Es gibt jedoch viel mehr genetische Variationen zwischen Menschen und Mäusen als zwischen Menschen. Das bedeutet, dass die von den ASOs von WAVE anvisierten SNP-Variationen nicht mit Mäusen geteilt werden und daher nicht an ihnen getestet werden können.
Was hat WAVE getan? Die von WAVE entwickelten spezifischen Medikamente wurden in Zellen in einer Petrischale getestet, wo sie das mutierte Protein erfolgreich senkten, während sie die normale Version relativ unberührt ließen. Forscher bei WAVE argumentieren, dass – für HD – der Fall für die Senkung des HD-Gens so klar ist, dass zusätzliche Tierstudien Zeitverschwendung wären.
Das bedeutet nicht, dass diese Studien nicht sicher sind – bevor ein Medikament an Menschen verabreicht wird, selbst experimentell, muss es gründlich an Tieren getestet werden, um sicherzustellen, dass es nicht toxisch ist. WAVE hat die Arbeit, die sie an Tieren geleistet haben, um zu beweisen, dass diese Medikamente nicht toxisch sind, nicht öffentlich detailliert, aber seien Sie versichert, dass die Aufsichtsbehörden, die für die Genehmigung dieser Studien zuständig sind, die Ergebnisse solcher Experimente gesehen haben werden.
Wie sind die Studien organisiert?
Die WAVE-Studien werden offiziell als Phase 1b/2a-Studien bezeichnet. Eine Phase-1-Studie ist eine Studie, bei der das Hauptziel der Studie darin besteht, zu verstehen, ob das Medikament bei einer kleinen Anzahl von Freiwilligen sicher ist. Normalerweise wird eine Phase-2-Studie an einer etwas größeren Anzahl von Personen durchgeführt, mit dem Ziel, ein wenig Beweise dafür zu sammeln, dass das Medikament wirken könnte. In diesem Fall, weil jeder so schnell wie möglich vorankommen möchte, hat WAVE die Studie so strukturiert, dass sie Aspekte einer Phase-1- und 2-Studie kombiniert. Das bedeutet, dass sie testen werden, ob das Medikament toxisch ist (Phase 1), aber auch, ob es Auswirkungen auf verschiedene wichtige Symptome von HD hat (Phase 2).
Ähnlich wie bei der laufenden Ionis-Studie wird das Medikament von WAVE durch Lumbalpunktion in die CSF injiziert. Dies ermöglicht es Forschern, ein wenig von der Rückenmarksflüssigkeit zu entnehmen, die das Gehirn und das Rückenmark umgibt, in der wir nun den Spiegel des schädlichen Huntingtin-Proteins messen können. Wir hoffen, dass WAVE dadurch tatsächlich messen kann, was sie zu tun versuchen, nämlich den Spiegel des mutierten Huntingtin-Proteins im Gehirn zu senken.
Wie kann man an der Studie teilnehmen?
WAVE zielt darauf ab, weltweit 50 Menschen mit HD für jede der beiden Studien zu rekrutieren. Das ist eine kleine Zahl, aber wenn das Medikament sicher ist, werden sie zu größeren Studien mit mehr Menschen übergehen, um zu untersuchen, ob es tatsächlich wirkt. Die aktuelle Studie wird in Kanada beginnen und dann Patienten in Europa und den USA aufnehmen. Um berücksichtigt zu werden, müssen Sie ein Erwachsener über 18 Jahre sein und mit der Entwicklung von Symptomen begonnen haben. Es gibt keine Möglichkeit, die Farbe der Bänder in Ihrer DNA zu erkennen, indem man Sie nur ansieht, daher werden berechtigte Personen einen Gentest durchführen lassen, und wenn sie einen der beiden SNPs haben, werden sie in die Studie aufgenommen. Der beste Weg, sich zu beteiligen, ist, Ihrem klinischen Team Ihr Interesse an der Forschung mitzuteilen.
Was bedeutet das für die HK?
Wir sind alle hoffnungsvoll, dass das Ionis-ASO das erste Medikament sein wird, das HD verlangsamt oder stoppt. Es ist jedoch wichtig zu erkennen, dass dies das erste Mal ist, dass diese Medikamente bei Menschen eingesetzt werden. Obwohl sie Mäuse viel besser gemacht haben, sind Menschen eine sehr unterschiedliche Spezies. Selbst wenn sie den Proteinspiegel bei Erwachsenen senken, sind sie möglicherweise nicht wirksam, da Schäden, die früher im Leben entstanden sind, irreparabel sind. Sie könnten auch Nebenwirkungen bei Menschen haben, die bei Mäusen nicht aufgetreten sind. Während die Medikamente von WAVE den Spiegel des normalen Proteins nicht beeinflussen sollten, könnten sie mit anderen RNAs reagieren, was zu einer Verringerung ihrer Proteinspiegel führt. Wir sind jedoch begeistert und optimistisch in Bezug auf Huntingtin-senkende Behandlungen, und die neueste Verfeinerung von WAVE sieht aus, als könnte sie ein aufregender Fortschritt sein.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…