Das schädliche Huntingtin im Gehirn erkennen
Neu entwickelte Tracer machen schädliche Huntingtin-Verklumpungen im Gehirn sichtbar.
 Von Dr Rachel Harding 24. Dezember 2021 Bearbeitet von Dr Jeff Carroll Übersetzt von Rebecca Ursprünglich veröffentlicht am 7. Dezember 2021
Von Dr Rachel Harding 24. Dezember 2021 Bearbeitet von Dr Jeff Carroll Übersetzt von Rebecca Ursprünglich veröffentlicht am 7. Dezember 2021
Forscher haben es mit speziellen Scannern geschafft, Verklumpungen des schädlichen Huntingtin-Proteins sichtbar zu machen. Menschen mit der Huntington-Krankheit stellen im Körper diese giftige Form des Eiweißes her, dass sich in ihren Gehirnzellen anhäuft und verklumpt, wenn die Krankheit weiter fortschreitet. Nachzuverfolgen, wie sich diese Klumpen über die Zeit hinweg bilden oder sich auch durch Einfluss unterschiedlicher Behandlungen verändern, könnte dabei helfen, die Krankheit besser zu verstehen und potentielle Heilungsmethoden zu untersuchen.
Eiweißklumpen
Jeder Mensch hat zwei Kopien des Huntington-Gens. Bei Menschen mit der Huntington-Krankheit ist allerdings mindestens eine dieser Kopien mutiert und zeigt eine ungewöhnliche Länge durch die sich immer wieder wiederholenden Genbausteine “C”, “A” und “G”. Bei gesunden Menschen wiederholt sich die Abfolge höchstens 35 mal, bei Huntington-Patienten öfter.
Das Huntington-Gen ist das Rezept für die Produktion des Eiweißes Huntingtin. Wenn das Rezept mutiert ist, ist auch das nach seiner Anleitung im Körper hergestellte Protein mutiert. Proteine werden aus langkettigen Molekülen namens Aminosäuren zusammengesetzt. Die DNA-Buchstaben “C-A-G” entsprechen dabei der Aminosäure Glutamin. Eine höhere Anzahl an CAG-Wiederholungen entspricht im Eiweiß also einer höheren Anzahl an Glutamin. Diese mutierten Huntingtin-Moleküle können sich nicht mehr wie das wilde Huntingtin verhalten und bilden schädliche Verklumpungen.
Das ist nun schon seit langer Zeit bekannt, denn die verklebten Eiweiße sind unter dem Mikroskop im Hirngewebe von verstorbenen Huntington-Patienten sichtbar. Betroffene hatten eingewilligt, ihr Gehirn nach ihrem Tod für die Forschung zu spenden. Allerdings ist die Untersuchung der Eiweißklumpen bei lebenden Patienten bisher schwierig gewesen.
Warum sind diese Klumpen von Interesse?
Wissenschaftler in verschiedenen Laboren im Vereinigten Königreich, Deutschland, Italien, Schweden und den USA haben molekulare Werkzeuge entwickelt, die nun die Verklumpungen in lebenden Tiermodellen sichtbar machen können. Hoffentlich auch bald im menschlichen Gehirn. Die Moleküle sind mit Radionukliden versehen und binden sich an die Huntingtin-Verklebungen, sodass diese mithilfe von Positronen-Emissions-Tomographie (PET) erfasst werden können.
Man spricht bei diesen Molekülen auch von PET-Tracern. Solche werden schon in vielen medizinischen und diagnostischen Anwendungen eingesetzt und erlauben es Ärzten und Forschern, Bilder von verschiedenen Körperteilen zu erstellen. Es gibt welche, die verschluckt und welche, die injiziert oder eingeatmet werden müssen, je nachdem, was genau untersucht werden soll. Sobald der Patient den Tracer im Körper hat, wird der entsprechende Bereich im Tomographen abgerastert. Da die Tracer gezielt nur an bestimmte Stoffe binden, wird der Bereich nur dort aufleuchten, wo der gesuchte Stoff - in unserem Fall mutiertes Huntingtin - vorhanden ist. Im Fall der Krankheit Alzheimer bilden sich ähnliche Verklumpungen und auch hier wurde bereits ein solcher Tracer entwickelt, Pittsburg Compound B.
PET-Tracer, die es Forschern erlauben, schädliche Eiweißklumpen zu sehen, sind aus mehreren Gründen nützlich. Als Erstes, können PET-Scans immer wieder gemacht werden, sodass man den Verlauf bei einem Patienten beobachten kann. Das ist bei anderen Untersuchungsmethoden nicht der Fall, die meisten können gar erst post-mortem durchgeführt werden.
Weiterhin handelt es sich um eine nicht-invasive Methode, die einen direkten Einblick in das Gehirn ermöglicht. Beispielsweise ist sie weniger beanspruchend und wesentlich genauer als eine Lumbalpunktion, bei der über eine Messung von Huntingtin im Nervenwasser ebenso Rückschlüsse auf das Gehirn gezogen werden könnten.
Außerdem sind die Tracer spezifisch auf das mutierte Huntingtin angepasst, erfassen also nicht die wilde/gesunde Form des Huntingtins.
Entwicklung des ersten PET-Liganden für Huntingtin
Vergangenen August wurde eine frühe Version des neuen Tracers namens CHDI-180R publiziert - es war das erste Mal, dass ein PET-Tracer für die Huntington-Krankheit hergestellt worden war. Eine Gruppe unter der Leitung von Celia Dominguez von der CHDI-Stiftung zeigte, dass ihr Molekül CHDI-180R zuverlässige Verbindungen mit mutiertem Huntingtin in einer Gewebeprobe eingehen konnte. Sie zeigten auch, dass eine Bildgebung bei Huntington-Mäusen damit erfolgreich realisiert werden konnte.
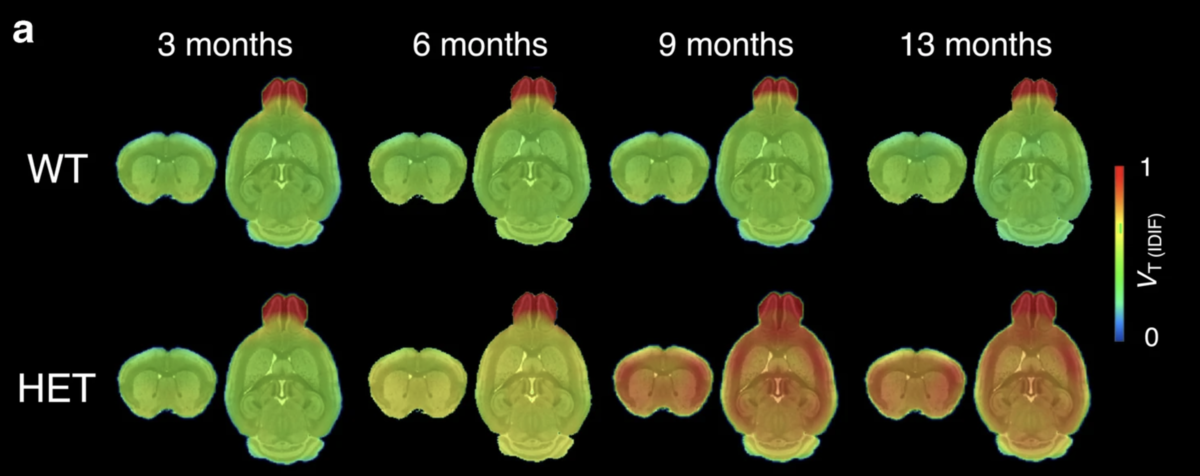
Bei den Huntington-Mäusen wurden die Klumpen in diversen Bereichen des Gehirns entdeckt, von denen man bereits weiß, dass sie durch die Huntington-Krankheit stark betroffen sind. Normale Mäuse zeigten dagegen nach der Injektion von CHDI-180R keinerlei dieser Klumpen. Auch in weiteren Tiermodellen (Affen und Ratten), konnte sich der Wirkstoff im Gehirn gut verteilen und war gut verträglich.
Feinabstimmung der Werkzeuge
Um den besten Tracer zu entwickeln, braucht es oft mehrere Anläufe und die oben genannte Forschergruppe hat bereits weitere Versionen in petto. Diese hoffentlich verbesserten Versionen werden gerade auf ihre Leistung hin getestet.
Weitere Tracer, die bereits für Alzheimer zum Einsatz kommen, wurden in Tierstudien auch bereits für die Anwendung bei Huntington mit erfolgreichen Ergebnissen getestet. Die Wissenschaftler arbeiten daran, Studien an Patienten folgen zu lassen.
Was kommt als Nächstes?
Eine klinische Studie namens iMagemHTT ist in der Durchführung, die die neuen Huntingtin-Tracer im Menschen testen soll. Es werden PET- und MRT-Untersuchungen durchgeführt. Die Phase-I-Studie hierzu und vielversprechende Daten waren auch Thema in unserem Bericht vom virtuellen CHDI-Treffen in diesem Jahr.
Da es sich bei den Eiweißklumpen im Gehirn um einen guten Biomarker handelt, könnten in Zukunft sowohl objektive eine Erfassung des Patientenzustandes als auch eine Therapiebegleitung bei Huntingtin-Verminderungstherapien mögliche Anwendungen sein.