
„Sehen“ des toxischen Huntingtin-Proteins bei Menschen mit HD
Neue Werkzeuge ermöglichen es uns, „Klumpen“ des toxischen Huntingtin-Proteins zu „sehen“, die sich im Laufe der Zeit im Gehirn von Menschen mit Chorea Huntington bilden. Die Verfolgung dieser Klumpen könnte uns helfen, besser zu verstehen, wie die Huntington-Krankheit fortschreitet oder wie Behandlungen die Huntington-Krankheit verlangsamen oder aufhalten könnten.

Wissenschaftler haben ein Werkzeug entwickelt, mit dem wir die toxischen Klumpen des Huntingtin-Proteins mithilfe spezieller Scanner „sehen“ können. Menschen mit Chorea Huntington (HD) bilden eine toxische Form des Huntingtin-Proteins, die in den Zellen ihres Körpers Klumpen bildet, die sich während des Fortschreitens der HD ansammeln. Die Verfolgung, wie sich diese Klumpen im Laufe der Zeit bei Menschen mit HD bilden oder wie sie sich verändern, wenn Menschen mit HD unterschiedliche Behandlungen erhalten, könnte uns helfen, das Fortschreiten der HD besser zu verstehen und welche Medikamente den Patienten am meisten helfen.
Was sind diese Protein-Klumpen?
Wir alle haben 2 Kopien des Huntingtin-Gens, aber bei Menschen mit Chorea Huntington (HD) weist eine ihrer Kopien eine Art Mutation auf, die als Repeat-Expansion bezeichnet wird. Diese Mutation tritt in einem sich wiederholenden Abschnitt des Huntingtin-Gen-DNA-Codes auf, bei dem sich die Buchstaben „C“, „A“ und „G“ immer wiederholen. Wenn Sie keine HD haben, haben Sie weniger als ~35 CAG-Wiederholungen in Ihrem Huntingtin-Gen, aber bei Menschen mit HD bedeutet die Mutation, dass sie mehr als 35 CAG-Wiederholungen in einem ihrer Huntingtin-Gene haben.
Das Huntingtin-Gen ist das Rezept, das unsere Zellen verwenden, um das Huntingtin-Protein herzustellen. Wenn sich also der DNA-Code dieses Rezepts ändert, ändert sich auch das Protein, das unser Körper herstellt. Proteine werden aus langen Ketten von Chemikalien, sogenannten Aminosäuren, hergestellt, wobei die in unserer DNA festgelegten Anweisungen befolgt werden. Die DNA-Buchstaben „CAG“ sind die Rezeptnotizen für die Aminosäure Glutamin. Dies bedeutet, dass, wenn die CAG-Wiederholungszahl größer wird, das Huntingtin-Protein viel mehr sich wiederholende Glutamine enthält. Huntingtin-Proteinmoleküle mit zu vielen Glutaminen können sich nicht richtig zusammenfügen und können daher toxische Klumpen bilden.
Wir wissen schon lange von diesen Klumpen und sie können im Gehirn von Menschen mit HD gesehen werden, wenn wir sie unter dem Mikroskop betrachten. Die Verfolgung dieser Klumpen bei lebenden Patienten ist jedoch eine Herausforderung, und der Großteil unseres Wissens über sie stammt aus der Betrachtung von Gehirnproben nach dem Tod von Tiermodellen der HD oder von Patienten, die ihr Gehirn freundlicherweise für die Forschung gespendet haben.
Warum wollen wir uns diese lästigen Klumpen ansehen?
Wissenschaftler aus vielen Labors in Großbritannien, Deutschland, Italien, Schweden und den USA haben molekulare Werkzeuge entwickelt, die es uns nun ermöglichen, diese Klumpen in lebenden Tieren und hoffentlich bald auch bei HD-Patienten zu „sehen“. Diese Werkzeuge binden an die Huntingtin-Protein-Klumpen und haben chemische Markierungen, sogenannte Radiolabel, was bedeutet, dass sie aufleuchten, wenn sie von einem PET-Scan (Positronenemissionstomographie) betrachtet werden.
Diese Art von molekularen Werkzeugen werden als PET-Tracer bezeichnet und werden in vielen verschiedenen medizinischen und diagnostischen Umgebungen verwendet, um es Ärzten und Forschern zu ermöglichen, bestimmte Teile Ihres Körpers abzubilden. Je nachdem, welcher Teil Ihres Körpers betrachtet wird, können verschiedene Arten von Tracern geschluckt, injiziert oder inhaliert werden. Sobald sich der PET-Tracer im Körper des Patienten befindet, wird er gescannt, und der Teil des Körpers, der betrachtet wird, leuchtet auf, wenn das Ziel des PET-Tracers vorhanden ist, da der Tracer leicht radioaktiv ist. Ähnliche Werkzeuge wurden für die Untersuchung anderer Krankheiten entwickelt, wie z. B. die Pittsburgh-Verbindung B, die verwendet wird, um ähnliche Klumpen bei Menschen mit Alzheimer zu untersuchen.
Die Herstellung von PET-Tracern, die es Forschern ermöglichen, die toxischen Klumpen des Huntingtin-Proteins zu sehen, ist aus mehreren Gründen eine attraktive Idee. Erstens kann ein PET-Scan bei Patienten zu mehreren Zeitpunkten im Laufe ihres Lebens durchgeführt werden, sodass wir verfolgen können, wie sich die Klumpen im Laufe der Zeit während des Fortschreitens der HD ansammeln. Viele unserer aktuellen Methoden zur Betrachtung von Huntingtin-Klumpen im Gehirn von Patienten können derzeit nur am Ende der Krankheit an postmortalem Gewebe durchgeführt werden.
Zweitens sind PET-Scans nicht-invasive Verfahren und ermöglichen es uns, direkt ins Gehirn zu schauen, während invasivere Verfahren wie die Messung des Huntingtin-Proteins in der Rückenmarksflüssigkeit nur einen Hinweis darauf geben, was unserer Meinung nach im Gehirn passiert. Drittens werden die Klumpen aus der toxischen Form des Huntingtin-Proteins gebildet, sodass PET-Scans es Forschern ermöglichen, spezifische Veränderungen dieser spezifischen Form von mutiertem Huntingtin zu messen. Dies unterscheidet sich von den meisten Arten, wie wir Huntingtin in Rückenmarksflüssigkeit oder Blut messen und analysieren, die alle verschiedenen Formen von Huntingtin messen, einschließlich des gesunden Huntingtin-Proteins.
Entwicklung des ersten Huntingtin-PET-Liganden
Letzten August wurde eine frühe Version dieser Werkzeuge namens CHDI-180R veröffentlicht – das erste Mal, dass ein PET-Tracer für das Huntingtin-Protein hergestellt wurde! Ein Team unter der Leitung von Celia Dominguez von der CHDI Foundation zeigte, dass das Werkzeugmolekül CHDI-180R in der Lage war, sehr fest an die toxischen Huntingtin-Protein-Klumpen in einem Reagenzglas zu binden. Sie verwendeten CHDI-180R auch, um zu zeigen, wo sich die Klumpen von toxischem Huntingtin in Gehirnproben von HD-Mausmodellen befanden.
Im Gehirn von Mäusen mit der HD-Mutation konnten Klumpen des toxischen Huntingtin-Proteins in vielen verschiedenen Hirnregionen gesehen werden, von denen bekannt ist, dass sie von HD betroffen sind, während im Gehirn von Mäusen ohne die HD-Mutation diese Klumpen nicht gesehen werden konnten, obwohl sie auch mit dem Werkzeugmolekül CHDI-180R injiziert worden waren. Schließlich zeigten die Wissenschaftler, dass sich CHDI-180R gut im Gehirn verteilte und auch bei Affen und Ratten sicher war und keine Nebenwirkungen hatte.
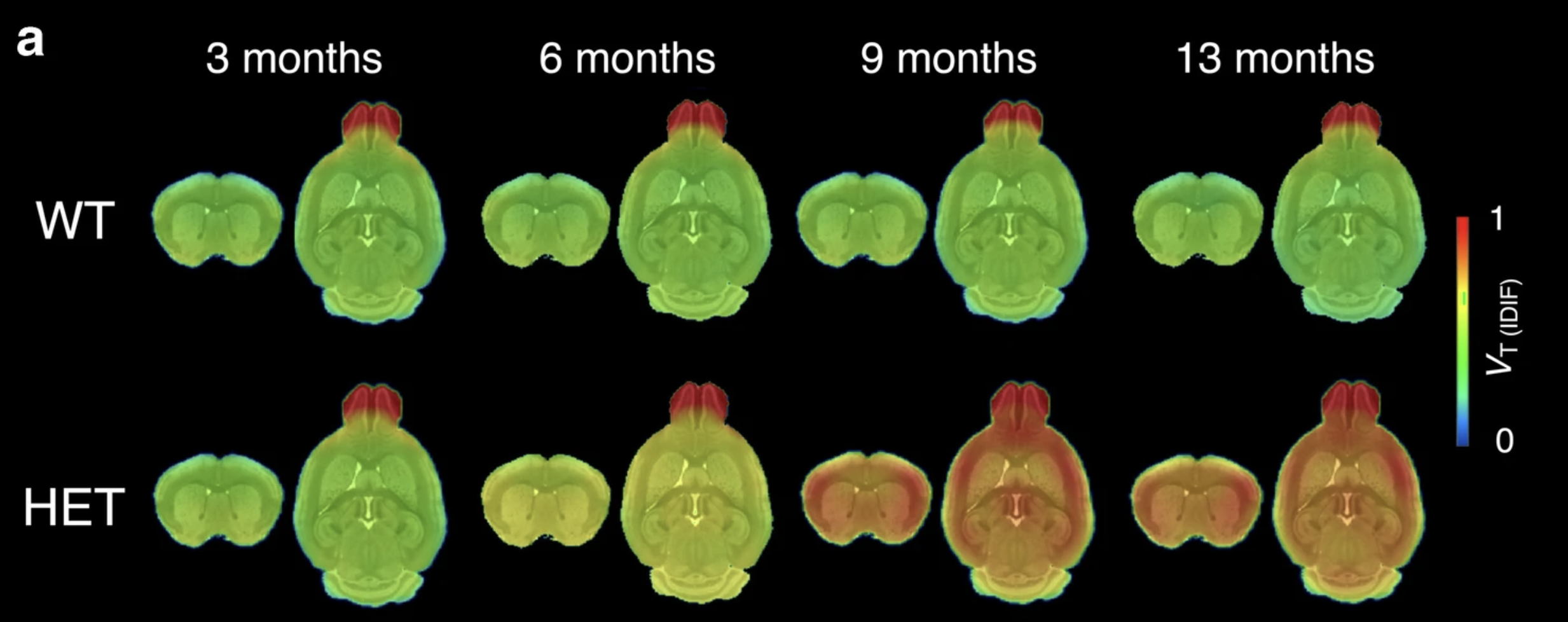
Bildnachweis: Bertoglio et al (2021) Eur J Nucl Med Mol Imaging
Feinabstimmung der Werkzeuge
Die Entwicklung von PET-Tracern erfordert oft mehrere Versuche, bevor ein optimales Werkzeug gefunden wird, daher entwickelt dieselbe internationale Gruppe von Wissenschaftlern auch andere Versionen dieses Tracers, um viele Backup-Optionen zu haben. Diese (hoffentlich) neuen und verbesserten Versionen des molekularen Werkzeugs werden getestet, um herauszufinden, wie sie sich im Gehirn der getesteten Tiere verteilen.
Andere Krankheiten wie Alzheimer haben auch Protein-Klumpen, die sich in Nervenzellen ansammeln, aber diese bestehen aus anderen potenziell toxischen Proteinen wie Amyloid-Beta. Die Wissenschaftler prüfen auch, wie spezifisch diese Werkzeuge für die Huntingtin-Protein-Klumpen sind, die sich im Laufe der Zeit bei HD-Patienten ansammeln, im Vergleich zu anderen Krankheits-Protein-Klumpen, wie z. B. denen von Alzheimer-Patienten. Bisher waren die Ergebnisse sehr ermutigend, sodass die Wissenschaftler nun daran interessiert sind, mit dem Testen der Tracer an Menschen zu beginnen.
Was kommt als Nächstes?
Es wird eine klinische Studie namens iMagemHTT-Studie durchgeführt, die den Huntingtin-Tracer bei Menschen untersuchen wird. In der Studie wird die PET/MRT-Bildgebung verwendet, um zu verstehen, wie der PET-Ligand Huntingtin im Gehirn verfolgt. Wir haben zuvor über einige ermutigende vorläufige Daten aus der
Die Menge an Huntingtin-Klumpen im Gehirn von Menschen mit HD ist ein guter Biomarker für das Fortschreiten der Krankheit. Biomarker sind objektive Messungen, die Wissenschaftler und Kliniker durchführen können, um das Fortschreiten der HD zu verfolgen, was wichtig sein kann, um die besten Behandlungsoptionen zu ermitteln und festzustellen, ob Behandlungen richtig wirken. Es ist möglich, dass HD-Patienten in Zukunft mithilfe dieser Art von Werkzeugen per PET-Scan überwacht werden.
Wenn die PET-Liganden so funktionieren, wie Wissenschaftler hoffen, könnten sie auch verwendet werden, um die Huntingtin-Senkung im Gehirn in zukünftigen Studien zu verfolgen. Trotz einiger Rückschläge ist die Huntingtin-Senkung immer noch eine vielversprechende Strategie zur Behandlung von HD, die von Novartis, PTC Therapeutics, Wave und Uniqure verfolgt wird, die alle klinische Studien durchführen. Unabhängig davon, was mit der Huntingtin-Senkung geschieht, geben diese aufregenden neuen Werkzeuge Wissenschaftlern die Möglichkeit – zum ersten Mal überhaupt – mutiertes Huntingtin-Protein im gesamten Gehirn lebender HD-Patienten zu verfolgen, was ein enormer Fortschritt ist.
Wir freuen uns darauf, Sie bald über dieses Thema zu informieren!
Mehr erfahren
- Bildgebung von mutierten Huntingtin-Aggregaten: Entwicklung eines potenziellen PET-Liganden (Open Access)
- [11C]CHDI-626, ein PET-Tracer-Kandidat für die Bildgebung von mutierten Huntingtin-Aggregaten mit reduzierter Bindung an AD-pathologische Proteine (Open Access)
- Longitudinale präklinische Bewertung des neuartigen Radioliganden [11C]CHDI-626 für die PET-Bildgebung von mutierten Huntingtin-Aggregaten bei der Huntington-Krankheit (Open Access)
- Pharmakologische Charakterisierung von auf mutierte Huntingtin-Aggregate ausgerichteten PET-Bildgebungs-Tracer-Kandidaten (Open Access)
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


