Ein wiederverwendetes Medikament ermöglicht uns neue Einblicke in die Huntington-Krankheit
Ein schon vorhandenes Medikament könnte Huntington-Neurone stärken, aber es ist noch weitere Forschung notwendig.
 Von Dr Leora Fox 3. April 2016 Bearbeitet von Dr Jeff Carroll Übersetzt von Christian Schnell Ursprünglich veröffentlicht am 15. Dezember 2015
Von Dr Leora Fox 3. April 2016 Bearbeitet von Dr Jeff Carroll Übersetzt von Christian Schnell Ursprünglich veröffentlicht am 15. Dezember 2015
Wissenschaftler haben eine Verbindung zwischen der Huntington-Krankheit (HK) und einem Energie-regulierenden Protein namens PPAR-delta gefunden. Die Aktivierung von PPAR-delta schützte zwar die HK-Zellen und Mäuse mit der HK, aber wir werden wohl noch einige Forschungsarbeiten und Tests durchführen müssen, bevor es klinisch gegen die HK verwendet werden kann.
Therapien umwidmen
Manchmal zeigt sich, dass ein vielversprechendes Medikament zwar sicher zur Behandlung von Menschen benutzt werden kann, es aber nicht genügend Nutzen aufweist, um die Krankheit, für die es entwickelt wurde, zu behandeln. In diesen Fällen können Wissenschaftler mit diesem Medikament neue Tests an Zellen oder Mäusen durchführen, um seine Funktion besser zu verstehen. Am Ende könnte dies zu einem sicheren Medikament führen, das für eine andere Krankheit umgewidmet werden kann.

Kürzlich wurde ein eingelagertes Diabetes-Medikament in Experimenten im Zusammenhang mit der HK untersucht. Das Medikament wirkt auf ein Protein namens PPAR-delta, das in den meisten Zelltypen im Körper vorkommt. Normalerweise hilft PPAR-delta bei der Regulierung des Energiekonsums von Zellen, besonders von Fett- und Gehirnzellen.
Diese neue HK-Forschung bestätigt wie wichtig PPAR-delta für die Energieversorgung von gesunden Gehirnzellen ist - und zeigt, dass die Huntington-Mutation einen Einfluss darauf hat, wie PPAR-delta seine Aufgabe erledigen kann. In HK-Zellen und -Mäusen führte eine Aktivierung von PPAR-delta mit einem Medikament zu gesünderen Zellen und erzeugte eine Verbesserung im Verhalten der Mäuse. Das ist sehr vielversprechend, aber es sind noch weitere Tests nötig, bevor das Medikament an Mäusen getestet werden kann.
PPAR-delta ist ein wichtiger Transkriptionsfaktor
HK-Forscher begannen sich für PPAR-delta zu interessieren, weil es ein Protein mit einer wichtigen Verwaltungsaufgabe in Zellen ist. Wie das Personal in einer großen Firma operiert jedes Protein in einer Zelle in einer empfindlichen Hierarchie von Koordinierung und Regulierung.
Einige Proteine begleiten und beaufsichtigen andere in kleinen Gruppen, andere beaufsichtigen wiederum diese Aufseher und sind selbst von Filialdirektoren beaufsichtigt und so weiter und so fort bis hin zum Vorstandsvorsitzenden. Zellen haben natürlich keinen echten Vorstandsvorsitzenden, aber die hochrangigen Proteine besitzen den Schlüssel zum Zellkern, dem Kontrollzentrum der Zellen, in dem die DNA gespeichert ist.
„Interessanterweise ähnelte die Anatomie und das Verhalten von Mäusen ohne PPAR-delta im Striatum dem von HK-Mäusen: Sie zeigten Schäden im Striatum, Bewegungsstörungen und hatten Schwierigkeiten mit kognitiven Aufgaben. Weniger PPAR-delta im Striatum bedeutet also nichts Gutes, da solche Mäuse den HK-Mausmodell ähneln. “
PPAR-delta ist für HK-Forscher ein interessantes Zielprotein, weil es eines dieser hochrangigen Proteine ist: Ein Transkriptionsfaktor. Diese Proteine starten und koordinieren den Prozess des Übersetzens der Information aus der genetischen DNA in ein funktionierendes Protein und entscheiden so am Ende, welche Proteine eine Zelle bauen muss, damit sie am Leben bleibt.
Wenn ein Protein wie PPAR-delta im Zentrum eines Netzwerks ist, das viele andere Elemente in einer Zelle steuert, wird es manchmal als “Hauptregulator” bezeichnet. Aufgrund seiner Schlüsselposition in der Steuerung der Gesundheit der Zelle ist ein Transkriptionsfaktor mit einer starken Verbindung zur HK ein vielversprechender Ansatzpunkt für Medikamente.
PPAR-delta und die HK in einer Laborkulturschale
Eine Gruppe von Wissenschaftlern der Universität von San Diego in Kalifornien schaut sich unter Leitung von Albert La Spada schon seit Jahren die Rolle von Transkriptionsfaktoren im Zusammenhang mit der HK an. Für ihre aktuelle Veröffentlichung testeten sie viele verschiedene Transkriptionsfaktoren um herauszufinden, welche typischerweise mit dem Huntingtin-Protein interagieren. PPAR-delta war eines von ihnen. Aber warum fokussiert man sich nun darauf?
PPAR-delta ist für einen Bereich des Zellbetriebs verantwortlich, der Mitochondrien baut und unterhält. Mitochondrien sind die Kraftwerke der Zellen. Gehirnzellen haben einen hohen Stoffwechsel, so dass sie viel Energie benötigen um überleben zu können. Zellen in dem Teil des Gehirns, den man als Striatum bezeichnet und die als erstes und am stärksten durch die HK betroffen sind, reagieren besonders empfindlich auf Probleme mit ihren Mitochondrien, so dass PPAR-delta hier besonders wichtig sein könnte.
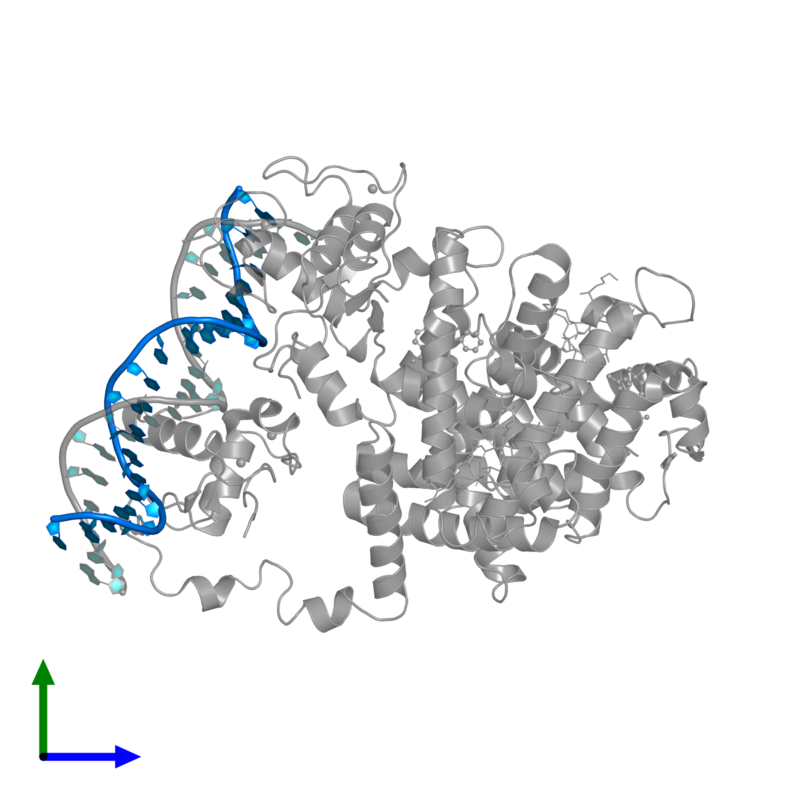
Das Team um La Spada experimentierte mit Proteinen und Zellen in einer Kulturschale um zu zeigen, dass das Huntingtin-Protein und PPAR-delta direkt aneinander binden. Dies ist ein wichtiger Hinweis, dass diese beiden Proteine in den Zellen zusammenarbeiten. Sie haben auch gesehen, dass die Huntington-Mutation zu einer Verringerung von PPAR-delta in der Zelle führte und dadurch die Versorgung von Mitochondrien gestört ist, was wiederum zu Schäden in Zellen führen kann und so zu deren Tod beiträgt.
Die Wissenschaftler konnten (noch in der Kulturschale) die beschädigten HK-Neurone reparieren, in dem sie sie mit einem PPAR-delta-Agonisten behandelten - einem Medikament, das PPAR-delta stärker aktiviert und damit effektiver in der Energieregulierung ist. Dieses Medikament namens KD3010 wurde ursprünglich von einer nicht mehr existierenden Biotech-Firma zur Behandlung von Diabetes entwickelt. Als die Forscher KD3010 auf HK-Zellen in einer Zellkulturschale gaben, schien es einen schützenden Einfluss auf die von der HK geschädigten Mitochondrien zu haben.
Übertragung der Experimente auf Säugetiere
Die Forschungsgruppe aus San Diego hat viele Experimente in Zellen und Mäusen durchgeführt, um zu zeigen, dass PPAR-delta wichtig für die Mitochondrien ist und notwendig für die Gehirngesundheit. Das allein ist schon ein wichtiger Beitrag, aber die Forscher wollten sich die Verbindung von PPAR-delta und der HK noch genauer ansehen.
Dazu nutzten sie eine gentechnische Methode, um PPAR-delta nur aus den Zellen des Striatums zu entfernen (dies sind die Zellen, die bei der HK am empfindlichsten betroffen sind). In anderen Worten: Können die Zellen immer noch funktionieren, wenn ein wichtiger Direktor nicht mehr da ist? Und wie beeinflusst dies den gesamten Organismus?
„Wenn KD3010 sein Versprechen auch nach weiteren Untersuchungen einlösen kann, wäre es sehr viel einfacher auch bei Menschen zu verwenden, da es in früheren Studien bereits als sicher für Menschen bewertet wurde. “
Interessanterweise ähnelte die Anatomie und das Verhalten von Mäusen ohne PPAR-delta im Striatum dem Verhalten von HK-Mäusen: Sie zeigten Schäden im Striatum und hatten Schwierigkeiten mit Bewegungs- und kognitiven Aufgaben. Weniger PPAR-delta im Gehirn ist also schlecht und die Mäuse ähneln Mäusen mit der HK. Dies untersützt die Idee, dass ein Verlust von PPAR-delta zur HK beitragen könnte und eine Aktivierung von PPAR-delta eine gute Strategie gegen die HK sein könnte.
Im nächsten Schritt wurde getestet, ob das PPAR-delta-aktivierende Medikament KD3010 einen Effekt bei HK-Mäusen hat. In den behandelten Mäusen fanden die Forscher gesündere Neurone im Striatum, schwache Verbesserungen im Bewegungsverhalten und eine etwas verlängerte Lebensspanne.
(Mögliche) Erfolgsaussichten im klinischen Alltag
PPAR-delta und sein Agonist KD3010 führten zu seinem Aufsehen in den Nachrichten, weil es sehr vielversprechend ist, wenn ein bereits als sicher gezeigtes Medikament vielversprechende Ergebnisse in Zellen und Mäusen zeigt. Allerdings sollte der Hype über eine mögliche klinische Studie in ein paar Jahren mit Vorsicht betrachtet werden. Auch wenn die Forschung einen großen Schritt in unserem Verständnis der Aufgabe von PPAR-delta im Gehirn nach vorne gemacht hat, muss die Verbindung zur HK erst noch bestätigt werden, bevor wir damit beginnen können, KD3010 bei Menschen mit der Mutation zu testen.
Folgendes haben wir aus diesen Arbeiten gelernt: Erstens ist PPAR-delta wichtig für das richtige Funktionieren des Gehirns, und es interagiert direkt mit dem Huntingtin-Protein. Zweitens wissen wir, dass das mutierte Huntingtin-Protein die Funktion von PPAR-delta beeinträchtigt, so dass es nicht korrekt arbeiten kann. Und drittens wissen wir, dass eine Erhöhung von PPAR-delta in HK-Zellen diese selbst und ihre Mitochondrien schützt.
Es gibt allerdings einige wichtige Limitierungen bezüglich des Einsatzes von KD3010 in naher Zukunft. Die Forscher haben das Medikament nur in einem der verfügbaren HK-Mausmodelle getestet und haben dort auch nur relativ geringe Verbesserungen im Verhalten feststellen können. Auch wenn diese Arbeit einige wichtige Verbindungen zwischen PPAR-delta und dem Huntingtin-Protein aufgedeckt hat, dürfte es sich nicht als förderlich erweisen, ein Medikament an Menschen zu testen, bevor es sich nicht in verschiedenen HK-Tiermodellen als effektiv erwiesen hat.
Dies ist also eine der ersten Untersuchungen der Aufgaben von PPAR-delta im Gehirn. Bevor man dem Gehirn aber einen medikamentösen Schutz gegen eine Krankheit geben kann, muss man unbedingt besser verstehen, wie es seine koordinierende Rolle in allen Zellen des Körpers ausübt. Dazu gehört auch, welche anderen Proteine und Signalwege es steuert und kontrolliert.
Nichtsdestoweniger würde die klinische Anwendung von KD3010 für HK-Patienten sehr viel einfacher sein, da seine Sicherheit für Menschen bereits gezeigt wurde. Vorher muss es aber seine Versprechungen auch in weiteren Experimenten einlösen. In der Zwischenzeit wird die Untersuchung der zentralen Kontrollproteine weitergehen, die für die HK relevant sind, um die Entdeckung von innovativen Behandlungen zu ermöglichen - seien es neue oder alte Behandlungsstrategien.


