Der Huntington Krankheit den Stinkefinger zeigen? Zwei Teams berichten Erfolg bei Zinkfinger-Wirkstoffen in Zellen und Mäusen
Erfolg bei HK Zellen und Mäusen für Zinkfinger Wirkstoffe, die die Produktion des schädlichen Proteins verringern
 Von Professor Ed Wild 4. November 2012 Bearbeitet von Dr Jeff Carroll Übersetzt von Michaela Winkelmann Ursprünglich veröffentlicht am 1. November 2012
Von Professor Ed Wild 4. November 2012 Bearbeitet von Dr Jeff Carroll Übersetzt von Michaela Winkelmann Ursprünglich veröffentlicht am 1. November 2012
Wirkstoffe zu entwerfen, die unsere Zellen anweisen, weniger schädliches mutiertes Huntingtin-Protein zu produzieren, ist eine der vielversprechendsten Ansätze zur Behandlung der Huntington Krankheit. Die meisten der bisherigen Anläufe zur Huntingtin-Senkung haben versucht, “den Nachrichtenüberbringer zu erschießen“, statt die Quelle der Nachricht anzugreifen - die DNA selbst. Nun geben zwei unabhängige Berichte über Erfolg in Huntington Mäusen einen Schub für „Zinkfinger” Wirkstoffe - die direkt mit dem Huntington Gen selbst interagieren. Es ist zu früh für diese neue Technologie: was wissen wir und welche Herausforderungen liegen vor uns?
Was in aller Welt sind Zinkfinger?
Zink ist ein glänzendes Metall, das in “Silber” Münzen, Batterien und weißer Farbe gefunden wird. Aber unsere eigenen Körper benutzen Zink für einen faszinierenden Zweck - welchen Forscher hoffen zu entwenden, um die Huntington-Krankheit zu bekämpfen. Es stellt sich heraus, dass Zink von entscheidender Bedeutung bei der Aktivierung der Zellen ist, um die Aktivität verschiedener Gene in unserer DNA zu kontrollieren. Beachten Sie, dass ein Gen eine Reihe von Anweisungen ist, buchstabiert mit den chemischen “Buchstaben” A, C, G und T. Jedes Gen hat eine andere Folge von Buchstaben und Zellen verwenden Zink-haltige Proteine, um der Kontrolle einzelner Gene auf der Grundlage ihrer spezifischen Folge von Buchstaben zu helfen.
Wenn Zink bei einem Gen-kontrollierenden Protein ankoppelt, formt es “Zinkfinger Proteine” - so genannt, weil sie in die enge Nut zwischen den beiden DNA-Strängen stechen können und berühren die Reihenfolge, für die sie gemacht sind.
Ein einzelner Zinkfinger kann jede drei Buchstabenkombinationen reizen, je nach Anordnung der Zink und Protein-Stücke, die ihn ausmachen. Also könnte ein Zinkfinger an der Sequenz ‘ATG’ kleben, während ein anderer “CAG” anstreben könnte.
Die spannende Sache ist, dass die einzelnen Zinkfinger in der Reihenfolge verbunden werden können. Diese beiden zusammenzubringen würde am Ende ein Molekül ergeben, das an der 6-Buchstabenfolge ATG-CAG klebt.
Designer Finger
Nach Jahrzehnten der Arbeit der Enthüllung und des Verständnisses der Funktionsweise der DNA und unserer Gene können die Wissenschaftler jetzt synthetische Zinkfinger erstellen, konstruiert um an jeder DNA-Sequenz zu kleben, die man gerne hätte.
Außerdem können diese synthetischen Zinkfinger Moleküle mit anderen Medikamenten optimiert und verpackt werden, um Mehrzweck-DNA-bindende Werkzeuge herzustellen, die festkleben, abscheiden, zusammenkleben und blockieren können.
Weil die Huntington-Krankheit durch ein einziges defektes Gen verursacht wird, ist es ein guter Kandidat für die Zinkfinger Medikamentenforschung.
Die Huntington-Krankheit tritt auf, wenn eine Person einen Rechtschreibfehler in dem Gen hat, das den Zellen sagt, wie ein bestimmtes Protein zu bilden ist - genannt Huntingtin. Wenn eine Person zu viele CAGs in einer Reihe nahe dem Beginn des Huntingtin-Gens hat, wird eine schädliche “mutierte” Form des Proteins produziert basierend auf den Anweisungen in dem Gen.
Blockieren des Huntington-Gens an seiner Quelle
Zwei Gruppen von Forschern - eine ein akademisches Team aus Barcelona, Spanien, die andere ein Biotech-Unternehmen aus Kalifornien namens Sangamo - haben gerade erfolgreiche Versuche mit Zinkfinger-Wirkstoffen verkündet, die das Huntington Gen als Ziel haben.
Die Ergebnisse des spanischen Teams wurden kürzlich in der Fachzeitschrift PNAS veröffentlicht. Sangamo’s Erkenntnisse wurden bei dem kürzlichen Treffen der Society for Neuroscience in New Orleans vorgestellt, wo HDBuzz im Publikum war.
Beide Teams entwickeln Zinkfinger Moleküle, die an dem “CAG-Abschnitt "des Huntingtin-Gens kleben und den Zellen sagen, das Gen nicht zu lesen.
Die Zinkfinger-Ketten wurden ausgewählt und verfeinert, um zu versuchen, damit sie so viel wie möglich, an der schädlichen langen CAG Ausdehnung festzukleben ohne an der normalen Länge festzuhalten. Das spanische Team nannte dies treffenderweise einen "molekularen Maßband”-Ansatz.
Nach ein wenig chemischem Basteln, hat jedes Team dann ihren besten Kandidaten der Zinkfinger Rezepte in wachsenden Zellen in einer Petrischale getestet.
Viral werden
„Sobald ein Zinkfinger auf eine bestimmte DNA-Sequenz zielt, sind theoretisch viele spannende Dinge möglich. “
Leider können die Wissenschaftler kein Zinkfinger Medikament genau entwerfen und herstellen und es auf Zellen spritzen oder es in eine Tablette stecken. Als Proteine sind Zinkfinger-Medikamenten groß, komplex und zerbrechlich. Wenn als Tablette geschluckt, würde das Medikament vom Verdauungssystem aufgelöst werden.
Auch wenn es als Injektion ins Blut gegeben wird, würde das Zinkfingerprotein das Gehirn nicht erreichen, geschweige denn so weit zu kommen wie der Kern unserer Neuronen, wo sie benötigt werden, um ihre Arbeit zu machen.
Um dieses Problem zu lösen, können die Forscher Viren verwenden, um in den Zellkern der Zellen zu “trampen”.
Nach der Wahl der Zinkfinger Proteinkette, die man will, ist es ziemlich einfach, eine DNA-Sequenz zu entwerfen, die den Zellen sagen wird, das bestimmte Protein herzustellen. Diese DNA-Sequenz kann dann in Teilchen eines Virus namens AAV angebracht werden, der harmlos, aber gut beim Infizieren der Neuronen ist.
Wenn der Virus eine geeignete Zelle trifft, spritzt er seine DNA Ladung in die Zelle, wandelt die Zelle in eine Fabrik zur Herstellung des Zinkfinger Wirkstoffes!
Untersuchungen in den Zellen
Das spanische Team verfeinerte ihre Top-Zinkfinger-Kandidaten in mehreren Arten von verschiedenen gentechnisch veränderten Zellen und Zellen, die aus der Haut von Huntington-Patienten gewachsen sind. Die Sangamo Forscher verwendeten auch diese Huntington Patientenzellen sowie Gehirnzellen von einem Huntington Mausmodell.
Die Zinkfinger Wirkstoffe beider Teams erledigten die Aufgabe der Verringerung der Aktivität von Genen, die lange CAG Ausdehnung beinhalten.
Nebeneffekte
Es gibt hier einen möglichen Haken. Das Huntingtin-Gen ist nicht das einzige mit einer langen CAG Ausdehnung - viele andere Gene haben das ebenfalls. Also könnte ein Medikament, das auf den CAG Abschnitt zielt, auch jene Gene ausschalten, was damit enden könnte, mehr zu schaden als zu nutzen.
Eine Eigenart des Huntingtin-Gens könnte hilfreich sein, wenn es darum geht, diese “Nebeneffekte” zu vermeiden. Der CAG-Abschnitt im Huntingtin-Gen ist sehr nah am Beginn des Gens, wo die Wirkungen der Zinkfinger-Medikamente am stärksten sind.
Beide Gruppen nahmen Messungen vor, um zu sehen, ob andere Gene von dem Zinkfinger-Wirkstoff beeinflusst wurden und fanden Ergebnisse, die im Großen und Ganzen beruhigend waren. Die Wirkungen waren klein im Vergleich mit der gewünschten Wirkung auf dem mutierten Huntingtin-Gen.
An Mäusen anwenden
Das spanische Team, das ein bisschen weiter ist in seiner Arbeit, brachte die Dinge auf die nächste Ebene durch die Prüfung ihrer besten Zinkfinger Kandidaten in einem Huntington Mausmodell.
Sie gaben den Mäusen eine einzelne Injektion in das Gehirn, das Viruspartikel verpackt mit DNA Instruktionen zur Herstellung der Zinkfinger Wirkstoffe enthält.
Die Aktivität des mutierten Huntingtin-Gens wurde im Gehirn nahe der Injektionsstelle um ungefähr 50 % reduziert. Das Auftreten von Klumpen von mutiertem Huntingtin-Protein wurde ebenfalls um etwa 40 % reduziert. Es gab keine Hinweise auf schädliche Wirkungen wie Gewichtsverlust, aber die Studie war zu klein, um zu wissen, ob die Zinkfinger-Wirkstoffe die Symptome verbessern.
Moment mal - ist das nicht genau Gen-Stummschaltung?
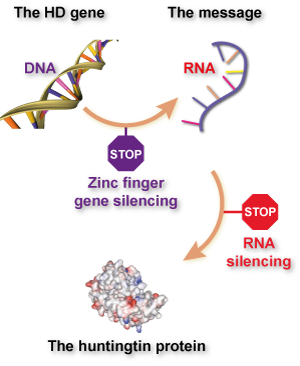
Wenn das, was Sie hier zur Zinkfinger-Technologie lesen, Sie an “Gen Stummschaltung” oder “Huntingtin-Senkungs-” Methoden zur Behandlung der Huntington-Krankheit erinnert, geben Sie sich einen goldenen Stern. Was diese Gruppen versuchen ist im Grunde “Gen Stummschaltung” mit einer Drehung - es zielt direkt auf die DNA, anstatt auf ein Nachrichtenmolekül namens RNA zu zielen.
Bisher haben sich die meisten Versuche, die Huntingtin Herstellung zu senken, auf das RNA-Nachrichten Molekül fokussiert, weil es einfacher ist, Medikamente zu entwerfen, die das Ziel RNA haben, statt der DNA. RNA schwimmt in den Zellen in einem einzigen Strang herum, während DNA in unseren Zellkernen verborgen ist. Außerdem gibt es RNA-Stummschaltungs-Medikamente schon länger und einige brauchen nicht in Viruspartikel verpackt zu werden.
Da RNA-basierte Gen-Stummschaltungs-Medikamente soweit erfolgreich waren, warum sich der größeren Herausforderung stellen, die DNA des Huntingtin-Gens selbst zu treffen, vor allem, wenn das den Umgang mit Viruspartikeln bedeutet und großen, zerbrechlichen Wirkstoffen aus Proteinen hergestellt? Es ist eine berechtigte Frage, und es gibt drei Antworten.
Die erste hat mit dem Erreichen der Wurzel der Huntington-Krankheit zu tun. Wir wissen sicher, dass die Mutation im Huntingtin-Gen der endgültige Grund ist, warum Menschen die Huntington Krankheit bekommen. Nach der DNA mit Zinkfingern zu schauen, bedeutet auf die bekannte Ursache der Erkrankung zu zielen. Während RNA ein wesentlicher Schritt bei der Herstellung des mutierten Proteins ist, ist es ein Schritt von der eigentlichen Ursache entfernt. Zinkfinger-Enthusiasten glauben, es lohnt sich zu versuchen, die zusätzliche Hürden für die Entwicklung von DNA-gerichteten Wirkstoffen zu überwinden, aufgrund der Möglichkeit, dass das Endergebnis sicherer und effektiver sein kann.
Die zweite betrifft die RNA. Traditionell sind Biologen davon ausgegangen, dass die RNA nicht direkt nützliche oder schädliche Dinge macht - sie sitzt einfach da, trägt die Informationen und wird durch die zelluläre Maschinerie gelesen. Aber man weiß jetzt, dass es um mehr geht als das, und es gibt mehrere genetische Krankheiten, wo die RNA direkt für die Zellen giftig ist, anstatt einfach nur das Tragen einer schädlichen Nachricht.
Während sich alle einig sind, dass das mutierte Huntingtin-Protein die Hauptursache für die Schäden in der Huntington-Krankheit ist, denken einige Forscher, dass die Huntingtin RNA eine zusätzliche Quelle für Schäden sein könnte. Andere widersprechen, aber wenn die RNA schädlich sein könnte, scheint es ideal, zu verhindern, dass sie hergestellt wird, anstatt sie danach loszuwerden.
Der letzte Grund ist etwas jenseits der Stummschaltung. Es gibt mehr bei Zinkfingern als die Verringerung der Genaktivität. Sobald ein Zinkfinger auf eine bestimmte DNA-Sequenz gezielt hat, sind theoretisch viele spannende Dinge möglich.
Viele Jahre in die Zukunft gedacht, ist es möglich, dass Zinkfinger verwendet werden könnten, um molekulare Scheren und Leim zu dem mutierten Huntington Gen zu leiten, um die unerwünschten CAG-Wiederholungen “auszuschneiden”. Das ist als Erbgut Bearbeitung bekannt, und es ist einer der Ansätze, an denen Sangamo und andere interessiert sind, ihn zu verfolgen.
Vorteile, Nachteile
Die meisten der Huntington-Forscher, mit denen man spricht, sagen, dass Zinkfinger als eine Möglichkeit der Behandlung der Huntington-Krankheit “ziemlich cool” sind, und wir sind geneigt, dem zuzustimmen. Die Huntington Krankheit auf DNA-Ebene zu bekämpfen, der eigentlichen Ursache des Problems, ist definitiv etwas, das wir versuchen sollten, und wir sind erfreut, dass in kurzer Zeit Fortschritte durch zwei voneinander unabhängige Gruppen berichtet wurden.
Es ist wichtig zu bedenken, dass es eine lange Zeit dauern wird, bis sich diese Techniken verfeinern, die noch neu sind in der Medikamenten Entwicklungs Pipeline - und Dinge wie die Erbgut Bearbeitung werden Jahrzehnte dauern, bis sie zur Reife für Huntington Patienten kommen.
Unterdessen bleibt jeder bei Huntington begeistert über die laufenden Bemühungen rund um die Welt, um Huntingtin durch das Zielen auf die RNA zu senken. Diese Techniken sind sehr viel weiter und werden sehr bald menschliche Studien erreichen.


