Umleiten des Huntingtin-Proteins in Zellen
Kanadisches Team deckt Markierungen auf, die Huntingtin in Zellen umleiten, was Licht auf dessen toxische Wirkung wir
 Von Dr Jeff Carroll 2. April 2012 Bearbeitet von Professor Ed Wild Übersetzt von Martin Oehmen Ursprünglich veröffentlicht am 26. Juni 2011
Von Dr Jeff Carroll 2. April 2012 Bearbeitet von Professor Ed Wild Übersetzt von Martin Oehmen Ursprünglich veröffentlicht am 26. Juni 2011
Das mutierte Huntingtin-Protein verursacht die Huntingtonkrankheit, aber nicht alle Formen des mutierten Proteins sind gleich toxisch. Die Lokalisierung des mutierten Proteins innerhalb der Zelle hat großen Einfluss darauf, wie gut die Zelle damit zurecht kommt. Neue Einsichten helfen dabei die Signale zu verstehen, welche das mutierte Huntingtin in Zellen umherleiten, und geben Hinweise darauf, wie man dessen Toxizität herabsetzen kann.
Huntingtin - und sein böser Zwilling
Die Huntingtonkrankheit wird durch eine genetische Abnormität verursacht und der Schaden, welchen sie an Zellen anrichtet, wird durch das mutierte Huntingtin-Protein verursacht. Das HK Gen stellt eine Anleitung dafür dar, wie das Huntingtin-Protein herzustellen ist. In Menschen, welche die Mutation tragen, sorgt ein “Schreibfehler” in dieser Anleitung dafür, dass ein bestimmter Teil des Proteins länger wird als vorgesehen. Zu viele Bausteine, die “Glutamin” genannt werden, werden an einem Ende des Proteins aneinander gereiht.

Zu viele dieser Glutamin-Bausteine in dem betroffenen Proteinabschnitt hat verherende Auswirkungen und ist der Grund für die schädigende Wirkung das mutierten Huntingtins.
Eine der Hauptaufgaben der Huntingtonforschung ist es, genau heraus zu finden in wie weit sich das mutierte Protein von der gesunden Form unterscheidet und wie diese Unterschiede die Zellen schädigen. Jede kleinste Information darüber wie das Protein Schaden verursacht ist ein möglicher Hinweis zur Auffindung von Behandlungsmöglichkeiten.
Ray Truant von der McMaster Universität in Ontario, Kanada, erforscht die Huntingtonkrankheit. Truant und seine Gruppe an Wissenschaftlern haben das Huntingtin-Protein über viele Jahre hinweg erforscht und fanden viel über dessen Wirkungsweise heraus und darüber was in der Huntingtonkrankheit schief läuft.
Das N-terminale Fragment
Huntingtin ist ein großes Protein, so dass es schwierig ist es im Ganzen zu studieren. Nachdem das zugrunde liegende Gen 1993 entdeckt wurde, war schnell klar, dass der gesundheitsschädlichste Teil des mutierten Proteins nahe seines Anfangs liegt. Wissenschaftler nennen diesen Abschnitt des Huntingtins, der die zusätzlichen Glutamine enthält, das “N-terminale Fragment”.
Neben der kritischen Region, welche in der HK die Mutation aufweist, hat das N-terminale Fragment des Hintingtin-Proteins noch eine Reihe an anderen interessanten Merkmalen. Wissenschaftler studieren es nun seit nahezu 20 Jahren und finden nach wie vor unerwartete Eigenschaften dieses kurzen Proteinabschnittes - Eigenschaften, die einen starken Einfluss auf Zellen haben.
Gepäckabfertigung in Zellen
Truants Labor hatte schon zuvor entdeckt, dass die ersten 17 Bausteine (Aminosäuren) des Huntingtins besonders wichtig sind. Sie verhalten sich ein wenig wie eine Adresszeile für das gesamte Protein.
Abhängig von der Situation, in der sich eine Zelle befindet, werden kleine chemische “Anhänge” an die ersten 17 Aminosäuren angehängt oder von ihnen entfernt. Die Transportmaschinerie der Zelle kann diese Markierungen wie einen Strichcode lesen. Abhängig von den Vorhandenen Markierungen wird das Huntingtin-Protein zu verschiedenen Orten in der Zelle transportiert. Obwohl diese 17 Aminosäuren nur einen winzigen Teil des gesamten Proteins ausmachen, können sie einen riesigen Einfluss auf die Lokalisierung und Funktion des Huntingtin-Proteins haben.
Das hinzufügen und entfernen dieser kleinen Markierungen wird “post-translationale Modifizierung” genannt. “Translation” ist der Vorgang bei dem Proteine erzeugt werden, nach Anleitung aus der DNA in unseren Genen, so dass “post-translational” einfach “nachdem das Protein hergestellt wurde” bedeutet.
Die magischen Zahlen: 13 und 16
„Spezifische Markierungen an der 13. und 16. Aminosäure des Huntingtins bestimmen, ob es im Nukleus endet oder nicht. “
Die post-translationalen Modifikation zu verstehen ist sehr wichtig in der HK, da es einen Einfluss darauf zu haben scheint, wie schadhaft das Protein ist. Zum Beispiel fand 2009 eine Gruppe um William Yang von der UCLA heraus, dass das Anfügen von zwei dieser Markierungen in HK Mäusen dazu führte, dass sie keinerlei Symptome zeigten. Diese Markierungen wurden an die Aminosäure 13 und 16 des Huntingtin-Proteins angefügt.
Da diese beiden chemischen Markierunge sehr wichtig dafür sind wie toxisch das mutierte Huntingtin-Protein ist, ist es wichtig sie im Detail zu verstehen. Truants Gruppe nahm sich vor die Auswirkung dieser zwei Markierungen auf die Lokalisation des Proteins zu untersuchen und wie viel Schaden es verursacht, wenn es sein Ziel erreicht hat.
Was fanden sie heraus?
Zunächst studierten die Wissenschaftler dier Proteine in lebenden Zellen, die in einer Petrischale im Labor gezüchtet wurden. Sie veränderten die Zellen genetisch dahingehend, dass sie nur die ersten 17 Aminosäuren des Huntingtin-Proteins produzierten, welche sie N17 nannten. Das N17 Huntingtin-Fragment wurde mit einem Protein aus einer einer Qualle verknüpft, das gelb leuchtet. Somit konnten sie die Bewegung des N17 Fragments innerhalb der Zellen beobachten.
Truants Gruppe fand heraus, dass die Markierung des Huntingtin-Fragments an den kritischen Stellen 13 und 16 bewirkte, dass es sehr viel öfters im Zellkern auftauchte.
Der Nukleus (Zellkern) ist ein sehr wichtiger Teil der Zelle - hier wird die DNA aufbewahrt, kopiert und abgelesen. Viele Wissenschaftler hatten die Vermutung, dass Huntingtin toxischer auf Zellen einwirkt, wenn es im Zellkern vorkommt. Aber es kann auch ausserhalb des Nukleus Schaden verursachen, so dass es wichtig war heraus zu finden, wo es am schadhaftesten ist.
Die Gruppe ging noch einen Schritt weiter und zeigte, dass Huntingtin an ganz bestimmten Stellen im Nukleus auftritt. Sie entwickelten zudem eine neue Technik, um nur die markierten Versionen des Proteins zu beobachten und nicht all die unmarkierten Kopien. Diese Methode wird für zukünftige Untersuchungen, welche auf die Rolle des Markierungsprozesses abzielen, sehr wichtig sein.
Wie sieht es mit Medikamenten aus?
Diese Arbeit zeigt, dass bestimmte Markierungen an den Aminosäuren 13 und 16 des Huntingtins dabei helfen fest zu stellen, ob es im Nukleus endet oder nicht. Dies führte zu der Idee, dass Wirkstoffe, welche auf die Markierungen dieser Aminosäuren einfluss nehmen, vielleicht in der Lage sind, den Schaden an den Zellen zu reduzieren.
Wie würde ein solches Medikament funktionieren? Oder in der Sprache der Wirkstoff-Jäger, was wäre sein “Angriffsziel”?
Die chemischen Markierungen werden an das Huntingtin-Protein durch Proteine angefügt, die “Kinasen” heißen. Und sie werden durch andere Proteine entfernt, die “Phosphatasen” heißen. Kinasen sind ein wenig wie ein Tacker, wohingegen Phosphatasen die Heftklammer wieder entfernen.
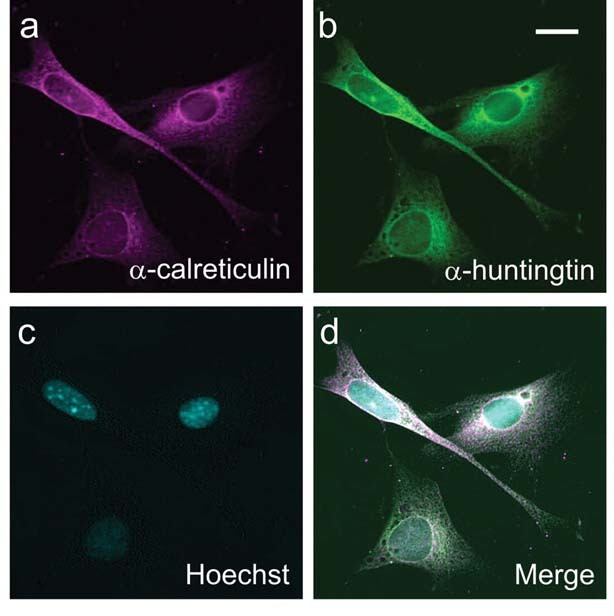
Laut Truants Arbeit sollten Wirkstoffe, welche die Aktivität der Kinasen (“Tacker”) reduzieren, die Anzahl der Markierungen an dem Huntingtin reduzieren und es aus dem Nukleus fern halten. Der nächste Schritt wäre dann festzustellen wo das Protein nun endet und ob es dort mehr oder weniger toxisch auf die Zelle einwirkt.
Um dies festzustellen, nutzte Truants Gruppe viele verschiedene Medikamente von denen bekannt war, dass sie Kinasen beeinflussen. Diese “Kinase-Inhibitoren” können Wissenschaftlern dabei helfen heraus zu finden, welche Kinase genau ihr Protein beeinflusst. Indem sie bestimmte Kinasen blockieren und anschließend die Lokalisation des Huntingtins in der Zelle bestimmen, können Wissenschaftler herausfinden, welche Kinasen für die Markierungen verantwortlich ist.
Nachdem sie Wirkstoffe getestet hatten, die 80 verschiedene Kinasen inhibieren, entdeckte die Gruppe eine spezielle Kinase mit dem Namen “Casein Kinase 2” - oder CK2 -, die eine wichtige Rolle spielt. Wie erwartet bewirkte die Inhibition von CK2, dass das Huntingtin viel weniger an den wichtigen Stellen markiert wurde. Huntingtin wurde vom Nukleus fern gehalten und statt dessen zur “Proteinfabrik” der Zellen transportiert, dem endoplasmatischen Retikulum, oder kurz “ER”. Hierdurch wurde der Schaden des Proteins auf die Zelle jedoch erhöht.
Einen Moment, sie machten das Protein noch toxischer?
Ein Wirkstoff, der die Toxizität von Huntingtin erhöht, ist das genaue Gegenteil von dem was wir in Menschen erreichen wollen. Also rennen sie nicht zur Apotheke und fragen nach einer Packung CK2 Inhibitoren.
Wenn diese Arbeit zur Behandlung von Huntington-Patienten beiträgt, wollen wir die Markierungen am Huntingtin erhöhen, nicht verringern. In diesem frühen Stadium war die Gruppe um Truant jedoch nur damit beschäftigt heraus zu finden, welche Kinase das best mögliche Ziel darstellt.
Indem sie in Zellen mit CK2 inhibierenden Wirkstoffen die Dinge schlimmer gemacht haben, konnten sie bestätigen, dass CK2 eine wichtige Rolle in dem Prozess der Markierung spielt, für den wir uns interessieren. Zukünftige Arbeiten können sich nun darauf konzentrieren wie man den Effekt umkehren und Huntingtin weniger toxisch machen kann.
Diese Arbeit, die an Zellen in Petrischalen durchgeführt wurde, ist noch sehr weit davon entfernt Behandlungen hervorzubringen, die in Patienten getestet werden können. Aber es ist ein wichtiger Schritt nach vorne und hilft uns dabei eine der Schlüsselfunktionen zu verstehen, durch die die Huntingtonkrankheit Zellen schädigt, und eröffnet neue Wege für Wissenschaftler an möglichen Behandlungsmethoden zu forschen.
Dieser Artikel wurde am 27. Juni überarbeitet, um die Auswirkungen des Markierens von Proteinen und der CK2-Inhibitoren näher zu erläutern.