Gen-Silencing bei der HK: Was bisher geschah
Ist Gen-Silencing für die HK so vielversprechend, wie es sich anhört - und was könnte die Zukunft bringen?
 Von Professor Ed Wild 9. September 2011 Bearbeitet von Dr Jeff Carroll Übersetzt von Nathalia Weber Ursprünglich veröffentlicht am 22. März 2011
Von Professor Ed Wild 9. September 2011 Bearbeitet von Dr Jeff Carroll Übersetzt von Nathalia Weber Ursprünglich veröffentlicht am 22. März 2011
Gen-Silencing bedeutet, speziell konstruierte Moleküle zu benutzen, um den Botenstoff, mit dem Zellen das schädliche Huntingtin-Protein herstellen, ‘auszuschalten’. Unsere Einführung in das Thema Gen-Silencing erklärt Techniken, bisherige Ergebnisse und zukünftige Herausforderungen.
Wir hatten zahlreiche Anfragen von Lesern, mit der Bitte, einen Artikel zum Thema ‘Gen-Silencing’ - auf Deutsch ‘Stilllegen’ von Genen - zu schreiben. Es handelt sich hierbei um ein Forschungsfeld, das zur Zeit viel Hoffnung schürt. Besonders viel Aufmerksamkeit wurde durch eine kürzlich erschiene Pressemitteilung auf das Thema gelenkt, in der eine Forschungskollaboration zwischen Lundbeck und der Universität Massachusetts (USA) zur Entwicklung von ‘RNA-Interferenz (RNAi)’ Therapien für die HK angekündigt wurde.
Was ist also Gen-Silencing? Wie funktioniert es und wie könnten HK-Patienten davon profitieren?

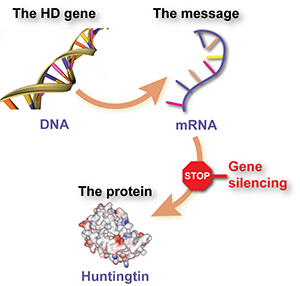
Gene, Botschaften und Proteine
Proteine sind Moleküle, die sich wie winzige Maschinen verhalten, welche einen Großteil der nützlichen Arbeiten in Zellen verrichten - Dinge wie chemische Reaktionen zum Laufen bringen, Nachrichten übermitteln, Zellen ihre Struktur verleihen und so weiter. Jedes Protein wird mittels einer Reihe von Instruktionen konstruiert, die man als Gen bezeichnet. Gene bestehen aus DNA und leben im Kontrollzentrum der Zelle, dem Zellkern, genannt Nukleus.
Gene werden jedoch nicht direkt zum Bau von Proteinen verwendet. Die Zelle nutzt die DNA-Sequenz eines Gens um daraus ein ‘Botenmolekül’, genannt ‘messenger RNA’ oder mRNA, herzustellen. Das mRNA-Botenmolekül wird dann benutzt, um der Zelle zu sagen, welche Bausteine sie zusammenstecken muss, um das Protein herzustellen.
Zusammenfassend kann man sagen, dass die DNA als Vorlage für die mRNA-Botschaft genutzt wird, die dann den Bauplan für Proteinmoleküle liefert.
Die Huntington Krankheit wird durch ein einziges abnormales Gen verursacht - das Gen, welches den Zellen sagt, wie ein Protein namens Huntingtin zusammengebaut werden muss. Jede Zelle hat zwei Kopien aller Gene. Die meisten Menschen mit der HK, oder solche, die sie später einmal bekommen werden, haben ein 'normales’ Gen und eines, bei dem die Sequenz ‘CAG’ zu oft wiederholt wird. Dieser einfache ‘Schreibfehler’ führt zu einem ‘mutierten’ Protein, das sich anders verhält als das normale Protein und so durch Beschädigung der Zellen die Symptome der HK verursacht.
Vielleicht haben Sie auch schon einmal den Begriff ‘Wildtyp’ gehört - das ist die wissenschaftliche Bezeichnung für nicht mutierte, oder ‘normale’ Gene und Proteine.
Das Huntingtin-Gen stilllegen
Wenn das abnormale Gen alle Probleme der HK verursacht - warum entfernt man es nicht einfach und ersetzt es durch ein gesundes Gen? Leider ist es unwahrscheinlich, dass dies funktioniert, da Zellen sehr gute Kontrollmechanismen haben, um Veränderungen oder Schäden an der DNA zu verhindern.
Das mRNA Botenmolekül hingegen bewegt sich frei in der Zelle und wird, solange es sich dort befindet, benutzt, um weitere Proteinmoleküle herzustellen. Wenn wir der Zelle also irgendwie beibringen könnten, die Botschaft der mRNA zu ignorieren, würde das schädliche Molekül nicht hergestellt werden. Genau das ist das Prinzip beim ‘Gen-Silencing’. Die Idee ist, dass Wissenschaftler ein Medikament entwickeln, das im Grunde nichts anderes als ein spezielles Botenmolekül ist, welches sich an die Huntingtin-mRNA heftet und der Zelle beibringt, diese auszustoßen.
Gen-Silencing klingt fast zu schön um wahr zu sein, doch das ist es nicht. Im Jahr 1998 fanden zwei Wissenschaftler, die später den Nobelpreis für Medizin verliehen bekamen, heraus, wie man einzelne Gene ausschalten kann. Sie nannten ihr Verfahren RNA-Interferenz (RNAi).
Gen-Silencing ist heute ein Standardverfahren, das von Wissenschaftlern genutzt wird, um herauszufinden, wie Organismen arbeiten und auf welchem Wege Krankheiten Schäden verursachen, und um Behandlungsmöglichkeiten zu entwickeln. Ein Gen-Silencing Medikament (Vitraven, zur Behandlung viraler Augeninfektionen) ist bereits für die Anwendung beim Menschen zugelassen, und dutzende Studien bei unterschiedlichen Krankheiten laufen zur Zeit, bzw. befinden sich in der Entwicklung.
Wenn das alles so einfach wäre, dann hätten wir bereits Gen-Silencing Tabletten für die Huntington Krankheit, also wo liegt das Problem? Nun ja, wie mit jedem neuen Verfahren begegnen einem auch hier Herausforderungen, Rückschläge und unerwartete Hürden.
Die erste Herausforderung: In das Gehirn gelangen
Eine der größten Schwierigkeiten ist es, die Gen-Silencing Moleküle dorthin zu bekommen, wo sie gebraucht werden. Bei der HK ist das Hauptproblem das Absterben von Gehirnzellen, Neurone genannt, weshalb wir das Molekül in genau diese Zellen bringen müssen.
„Mehrere verschiedene Forschergruppen haben jetzt über eine erfolgreiche Eindämmung der Huntingtin-Produktion im Tiermodell berichtet. “
Die erste Hürde ist nun, das Medikament in das Gehirn zu bekommen. Das Gehirn hat ein natürliches Schutzschild, um schädliche Substanzen davon abzuhalten, über das Blut dort einzudringen - die sogenannte Blut-Hirn-Schranke. Grundsätzlich ist das gut für uns, da es unser Gehirn schützt, doch es bereitet Medikamenten-Forschern bei der HK große Kopfschmerzen, weil es dadurch viel schwieriger ist, einen Wirkstoff ins Gehirn, als beispielsweise in die Leber oder Nieren, zu bringen.
Es ist also unwahrscheinlich, dass eine einfache Tablette oder Injektion ausreichen wird, um die HK mittels Gen-Silencing zu bekämpfen. Eine Möglichkeit dieses Problem zu umgehen ist es, das Medikament über winzige Pumpen und Schläuche direkt in das Gehirn, oder die darum liegende Flüssigkeit - den Liquor Cerebrospinalis - zu bringen. Das klingt ziemlich einschüchternd und zweifellos ist es eine größere Sache, Pumpen oder Schläuche in das Nervensystem zu implantieren, doch ähnliche Systeme werden bereits mit guten Erfahrungen genutzt, um Medikamente zur Behandlung von Multipler Sklerose (MS) und von Gehirntumoren zu verabreichen.
Die zweite Herausforderung: Verteilung
Befindet sich der Wirkstoff einmal im Nervensystem, ist das Problem der Verteilung noch nicht gelöst. Das Gehirn ist ein dichtes Gewebeknäuel, in dem sich ein Wirkstoff nur schwer verteilen kann. Darüber hinaus muss der Wirkstoff seine Wirkung im Inneren der Zellen entfalten können - um die Zellen herumzufließen genügt nicht.
Wissenschaftler nutzen eine Reihe von Methoden, um dieses Problem zu lösen. Unsere Nobelpreisgewinner nutzten RNA-Interferenz (RNAi) Moleküle, um Gene auszuschalten. Diese ähneln stark den von Zellen natürlicherweise produzierten Molekülen. Der Nachteil ist, dass diese sich nicht besonders gut im Gehirn verteilen und nicht so leicht in Zellen eindringen können.
Daher nutzen RNAi-Forscher gerne sehr feine Schläuche, die direkt zu den am schlimmsten betroffenen Regionen der Gehirnsubstanz geführt werden und mit Pumpen zur weiteren Verbreitung des Wirkstoffs verbunden sind. Eine weitere Option ist, die RNAi-Moleküle ‘per Anhalter’ mit inaktiven Viren mitzuschicken, die wahre Experten darin sind, sich im Gehirn auszubreiten und Stoffe in Zellen zu injizieren.
Ein anderer Ansatz ist der, verschiedene Moleküle auszuprobieren, die besser darin sein könnten, sich auszubreiten und in Zellen einzudringen. Antisense-Oligonukleotide (ASOs) ähneln den RNAi-Molekülen, sind aber etwas weniger komplex und werden nicht auf natürliche Weise von Zellen produziert. Das Prinzip ist das gleiche - sie heften sich an das mRNA-Botenmolekül und halten die Zelle so davon ab, diese zum Bau von Proteinen zu nutzen.
ASOs scheinen wesentlich besser darin zu sein, sich im Gehirn auszubreiten und können sehr einfach in Zellen eindringen. Sie scheinen auch eine wesentlich längere Haltbarkeit zu haben - was gut oder schlecht sein kann, je nach dem wie gut sie ihre Arbeit verrichten.
Welche Gen-Silencing Methode ist nun besser? Wir wissen es einfach nicht, daher wird parallel an RNAi und ASOs gearbeitet, um dies herauszufinden.
Die dritte Herausforderung: Das Gen ausschalten
Der zentrale Test einer Gen-Silencing Behandlung ist, ob es ihr gelingt, das fragliche Gen auszuschalten. In Studien mit Tiermodellen legen die bisherigen Erfahrungswerte nahe, dass dies sowohl mit RNAi- als auch mit ASO-Behandlungen möglich ist.
Im Jahr 2005 injizierte ein Team von Wissenschaftlern unter der Leitung von Bev Davidson in Iowa RNAi-Moleküle in die Gehirne von HK-Mäusen und erzielte so eine 85-prozentige Reduktion der Huntingtin-Botenmoleküle. Die Motorik und die Zellschäden der Mäuse verbesserten sich ebenfalls. Seither konnten diverse Forschungsgruppen Erfolge bei der Eindämmung der Huntingtin-Produktion berichten, sowohl mit RNAi- als auch mit ASO-Medikamenten. Neueste Arbeiten zeigen, dass sogar die Wirkung zeitlich kurzer Infusionen über einen längeren Zeitraum anhalten kann.
Die vierte Herausforderung: Das richtige Ziel identifizieren
Medikamentenforscher versuchen mögliche Probleme vorherzusehen, bevor sie überhaupt auftreten können. Ein mögliches Problem beim Gen-Silencing sind die Effekte, die die Behandlung auf die normalen Wildtyp-Kopien des Huntingtin-Gens hat.
Wir wissen bereits, dass es gefährlich ist, überhaupt kein Huntingtin zu haben. Mäuse ohne jegliche - gesunde oder kranke - Kopie des Gens sterben noch vor der Geburt. Die zentrale Frage ist also, ob die therapeutisch notwendige Reduktion des mutierten Huntingtins mit einer ungewollten und gefährlichen Reduktion des gesunden Huntingtins einhergeht.
Momentan wissen wir dies nicht. Einige Wissenschaftler sind der Ansicht, dass auch kleine Reduktionen des mutierten Huntingtin ausreichend sind, um Zellen die Möglichkeit zur Erholung zu geben, weshalb wir uns nicht um die möglicherweise schädlichen Effekte einer Reduktion des gesunden Proteins kümmern müssen. Andere hingegen glauben, dass wir Methoden finden müssen, bei denen ausschließlich das mutierte Protein ausgeschaltet wird. Dies nennt man allel-spezifisches Silencing - wobei ein Allel jeweils eine der beiden Gen-Kopien in unseren Zellen ist.
Allel-spezifisches Silencing klingt sehr vernünftig - wenn wir das mutierte Gen gezielt auswählen können, warum sollten wir es dann nicht tun? Der Nachteil ist, dass man in der DNA jedes Patienten nach Unterschieden in der “Schreibweise” zwischen zwei Allelen suchen muss, um so das kranke Allel zu identifizieren. Glücklicherweise sind solche Unterschiede recht häufig, man bräuchte aber vermutlich dennoch einige unterschiedliche Medikamente, um eine gezielte Therapie für möglichst viele Menschen zu ermöglichen. Einige Patienten könnten auch unzureichende Unterschiede in der Schreibweise haben, die auf diesem Wege gar nicht auffindbar sind.
Die Debatte darüber, ob allel-spezifisches Silencing notwendig ist geht weiter, doch glücklicherweise brauchen wir nicht länger auf die Antwort zu warten, da beide Techniken aktuell von verschiedenen Forschungsgruppen untersucht werden.
Die fünfte Herausforderung: Nebenwirkungen
Behandlungen durch Gen-Silencing könnten immer noch Nebenwirkungen haben, auch wenn mögliche Probleme durch eine Verringerung der Menge des normalen Huntingtins vermieden werden können.
Ein Problem sind sogenannte ‘Off-Target Effekte’, bei denen sich ein Wirkstoffmolekül an andere Botenmoleküle als solche für Huntingtin anheftet und diese so stört. Das könnte eine unvorhersehbare Zahl von Problemen mit sich bringen.
Ein anderes Problem ist, dass schließlich das Immunsystem des Gehirns die ‘fremden’ Moleküle bekämpfen könnte, was zu einer Verschlimmerung führen könnte.
Wir müssen diese möglichen Nebenwirkungen jetzt, da wir noch im Stadium der Versuche an Tieren sind, sehr ernst nehmen. Selbst relativ milde ungewollte Effekte könnten schlechte Nachrichten bedeuten, insbesondere, wenn Gen-Silencing bei Menschen mit positiven Testergebnissen über viele Jahre hinweg eingesetzt werden soll, um das Auftreten von Symptomen zu verhindern.
Wissenschaftler arbeiten daran, die sichersten Moleküle mit dem geringsten Risiko zu entwickeln, und nur die sichersten werden für Versuche an Menschen zugelassen werden.
Wann, wann, wann?
Die Erwartungshaltung gegenüber dem Thema Gen-Silencing ist gerechtfertigt, da viele Wissenschaftler davon ausgehen, dass dies unsere größte Chance auf eine wirksame Therapie der HK ist. Sicher gibt es noch viele Probleme, die es auszubügeln gilt, doch mit jedem weiteren Jahr gibt es neue Fortschritte und alle sind sich einig, dass bisher nichts gefunden wurde, was annehmen ließe, dass das Verfahren bei Patienten keine Wirkung zeigen könnte.
Aktuell ist ein Versuch mit ASO Gen-Silencing bei Patienten mit ALS (einer Erkrankung des Motoneurons) in der Vorbereitung. Dies ist sehr wichtig, da hier nicht nur das Medikament getestet wird, sondern auch das System aus Pumpen und Schläuchen, mittels dessen das Medikament an seinen Wirkort gebracht werden soll. In der Zwischenzeit erforschen Wissenschaftler weltweit, welche Moleküle sich am besten für einen solchen Versuch mit Huntington-Patienten eignen würden.
Wir können noch nicht genau sagen, wann Gen-Silencing Therapien für Patienten verfügbar sein werden, doch HDBuzz wäre enttäuscht, wenn wir nicht schon bald Gen-Silencing Tests für Menschen mit der HK sehen sollten.


