Präzise Huntingtin-Verminderungs-Studien mit Medikamenten, die ausschließlich auf das mutierte Protein zugeschnitten sind
WAVE Life Sciences startet zwei PRECISION Medikamenten-Studien zum gezielten Abbau des mutierten Huntingtins
Von Dr Michael Flower 8. September 2017 Bearbeitet von Dr Tamara Maiuri Übersetzt von Rebecca Ursprünglich veröffentlicht am 25. August 2017
Ein neues, aufregendes Kapitel in der Behandlung der Huntington-Krankheit wird gerade aufgeschlagen - WAVE Life Sciences hat offiziell zwei neue Studien zu Huntingtin-vermindernden Medikamenten angemeldet. Sie heißen PRECISION-HD1 und 2. Wir freuen uns über die beiden neuen Ansätze, auch wenn sie sich in einem frühen Stadium befinden und der Weg, um die Sicherheit und Wirksamkeit der Medikamente zu zeigen, noch lang sein wird.
Warum versucht man, die Menge des Huntingtin-Proteins zu verringern?
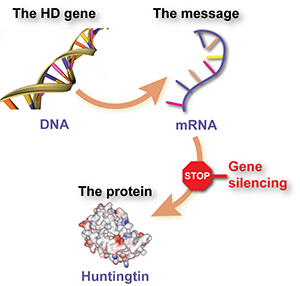
Wenn Gene das Handbuch darstellen, dass unsere Zellen benötigen, um unseren Körper zu formen, dann ist die DNA die Sprache, in der dieses Handbuch geschrieben ist. Jedes ihrer Kapitel ist für die Herstellung eines anderen Proteins zuständig. Diese tausenden von verschiedenen Proteinen bilden dann die Zellen unseres Körpers. Der wissenschaftliche Name des Huntington-Gens ist HTT und das Protein, das nach seiner Anleitung hergestellt wird, nennt sich Huntingtin.

Menschen haben zwei Kopien des HTT-Gens. Die Huntington-Krankheit entwickelt sich immer dann, wenn eine Mutation dafür sorgt, dass eine der Kopien zu lang wird. Das verlängerte Protein, dass auf Grundlage dieses Gens hergestellt wird, ist giftig für unsere Zellen, insbesondere diejenigen im Gehirn. Wir wissen, dass die Verringerung der Menge dieses mutierten Huntingtins im Mausmodell die aus der Huntington-Krankheit entstehenden Symptome bedeutend mildert, was Hoffnung darauf gibt, dass ähnliche Behandlungen auch beim Menschen wirksam sind.
Was bedeutet Huntingtin-Verminderung?
Genauso wie es mit vielen Antibiotika und auch Krebsmedikamenten passiert ist, können wir uns einen natürlichen Prozess zu nutzen machen, um die Herstellung von Huntingtin zu unterbinden. In diesem Fall greifen wir auf einen Mechanismus zurück, durch den Zellen ihre DNA instand halten und vervielfältigen.
Die DNA in unseren Zellen besteht meistens aus zwei verdrillten Strängen, die sich umeinander wickeln und die berühmte Doppelhelix bilden. Dieses Strangpaar ermöglicht es den Zellen ihre DNA nachzubilden oder zu vervielfältigen, indem die Stränge auseinander gezogen und je für als Muster für eine neue Kopie hergenommen werden. An verschiedenen Stellen in diesem Prozess, verwenden die Zellen die RNA als eine Art Gerüst, das hilft, die DNA nachzubilden. Wenn die Kopie erstellt wurde, muss dieses Gerüst wieder entfernt werden. Daher können unsere Zellen sehr effizient Verbundpäckchen aus RNA und DNA abbauen.
Die Zellen nützen die RNA auch zu einem anderen Zweck: zum Transport von genetischen Nachrichten innerhalb der Zelle. Wenn eine Zelle ein bestimmtes Protein - zum Beispiel Huntingtin - benötigt, wird eine Anfrage an die DNA-Manager der Zelle gesendet. Die DNA ist kostbar: wenn damit Unfug getrieben wird, kann das zu Krebsleiden oder zum Tode führen. Daher fertigen die DNA-Manager eine Kopie des betroffenen Gens an. Diese Kopie wird nicht als DNA, sondern in einer Sprache namens RNA erstellt. Sie ist eine RNA-Nachricht - genannt mRNA - und wird von Zellfabriken dazu verwendet, mehr Huntingtin herzustellen.
Diese mRNA Zwischenstufe, die Informationen zwischen der DNA und den Eiweißherstellern hin- und herträgt, ist das Ziel von Huntingtin-vermindernden Medikamenten. Die Absicht dieser Medikamente ist es, diese Nachricht auf verschiedene Wege zu zerstören, sodass ihre Anleitung zur Proteinherstellung die Zellfabriken nicht erreicht.
Was hat das mit der Huntington-Krankheit zu tun? Hier kommen die Antisense-Oligonukleotide oder “ASOs” ins Spiel. ASOs kommen natürlicherweise nicht vor. Sie sind von Wissenschaftlern erzeugt, um die Zellen dazu zu bringen, bestimmte mRNA-Moleküle zu zerstören. Im Prinzip sind die ASOs wie kurze Auszüge aus der DNA, die so modifiziert wurden, dass sie in Zellen eindringen können. Sobald sie drinnen sind, hängen sie sich an einen ganz speziellen Abschnitt der mRNA des Huntington-Gens.
Erinnern Sie sich an die Gerüste bei der Vervielfältigung von DNA und wie diese abgebaut werden? Wenn Zellen ein Verbundpäckchen aus DNA (jetzt das ASO) und RNA (jetzt die Huntington-mRNA) bemerken, gehen sie davon aus, dass es sich um ein solches übriggebliebenes Gerüst handelt und zerstören es. Schon haben wir die Zelle dazu gebracht, eines der vielen zehntausenden mRNA-Moleküle zu zerstören.
Eine große Herausforderung ist die Beförderung dieser ASOs in das Innere des Gehirns, da sie die Blut-Hirn-Schranke nicht überwinden können. Es ist möglich, diese Schranke zu umgehen, indem das Medikament direkt in die Gehirn-Rückenmarks-Flüssigkeit injiziert wird. Von dort werden die ASOs in die Gehirnzellen aufgenommen und können dann die Herstellung ihres Zielproteins für etwa einen Monat unterdrücken.
Wo liegen die Unterschiede zur bereits laufenden Huntingtin-Verminderungs-Studie?
Ionis Pharmaceuticals bewegen sich gerade auf das Ende einer aufregenden, klinischen Studie zu. Hier wird auch ein ASO eingesetzt, dass die Huntingtin-mRNA im Auge hat. Allerdings unterscheidet das Ionis ASO nicht zwischen der gesunden Huntingtin-mRNA und der mutierten Huntingtin-mRNA, wodurch die Menge sowohl des mutierten als auch des gesunden Huntingtins verringert wird. Daher muss an diese Therapie mit besonderer Vorsicht herangegangen werden, die Menge des gesunden Huntingtins zu verringern, könnte unproblematisch sein, könnte aber auch auf lange Sicht Risiken bergen. Immerhin wissen wir, dass das Vorhandensein des gesunden Huntingtins sehr wichtig bei der Entwicklung von Säuglingen ist. Jedoch haben Studien in verschiedenen Tiermodellen gezeigt, dass die zeitweise Unterdrückung der Produktion beider Proteine um etwa 50% in ausgewachsenen Tieren keine Probleme verursacht und deren Symptome verbessert.
Was WAVE nun macht, könnte diese Schwierigkeiten vermeiden, da beide eingesetzten Medikamente ganz spezifisch nur die Information des mutierten Gens anvisieren und die Information der gesunden Kopie nicht beeinträchtigen. Ermöglicht wird den Medikamenten das durch kleine genetische Unterschiede in der DNA, die man auf Englisch “Single Nucleotide Polymorphisms” oder kurz “SNPs (sprich: Snips)” nennt. Man kann sich diese SNPs zunächst als verschiedenfarbige Bänder an einem Drachen vorstellen. Jeder Mensch, der von der Huntington-Krankheit betroffen ist, würde dann zwei Drachen steigen lassen, einen “guten” und einen “bösen”. Das ASO wäre eine Drohne, die den bösen Drachen treffen soll. Diese Drohne kann nicht den Unterschied zwischen den beiden Drachen selbst erkennen, aber sie kann die unterschiedlich gefärbten Bänder am Drachen identifizieren. In unserem Fall reicht es, wenn die Drohne die Bänder erwischt, um den kompletten Drachen vom Himmel zu holen.
WAVE hat ASOs entwickelt, die zwei SNPs im HTT-Gen zum Ziel haben, daher werden auch zwei separate Studien gestartet. Diese SNPs wurden deshalb ausgewählt, weil ihre Abfolgen sich vom gesunden zum mutierten Huntington-Gen unterscheiden: die Bänder der Drachen haben also verschiedene Farben und sind für die Drohne unterscheidbar. An der Stelle des ersten SNPs, der in der Wissenschaft als “rs362307” bezeichnet wird, haben etwa die Hälfte aller Huntington-Betroffenen unterscheidbare Farben im guten und bösen Drachen. Beim zweiten SNP, “rs362331”, trifft das auf etwa 40% zu. Insgesamt, haben wohl mindestens zwei Drittel der Huntington-Betroffenen in Europa und den Vereinigten Staaten unterscheidbare Bänder, sodass eines der Medikamente in der Lage sein sollte, den bösen Drachen abzuschießen.
Leider bedeutet das auch, dass etwa ein Drittel der Betroffenen die gleichen Bänder an diesen Stellen aufweist und Gut und Böse durch die hier vorgestellten Medikamente nicht unterscheidbar sind. Allerdings kann im Fall von erfolgreichen Studien nach weiteren ASOs gesucht werden, die andere Bänder betrachten, bei denen dann hoffentlich Unterschiede vorliegen.
Welchen Nachweis gibt es, dass die Medikamente wirken?
Diese Studien von WAVE sind insofern besonders, dass die Firma vorher keine Versuche an Huntington-Tiermodellen durchgeführt hat. Mäuse und andere Tiere, die hier gerne von Wissenschaftlern eingesetzt werden, haben auch zwei Kopien des Huntington-Gens. Jedoch gibt es darüber hinaus viele Unterschiede zwischen ihrer und der menschlichen Genetik. Die SNPs, die von WAVE betrachtet werden, sind bei Mäusen nicht vorhanden. So können die Medikamente an ihnen natürlich nicht getestet werden.
Was hat WAVE gemacht? Die beiden von WAVE entwickelten Medikamente wurden an Zellen in einer Petrischale getestet. Dort haben sie erfolgreich die Menge des mutierten Proteins verringert, während die Menge des gesunden Proteins annähern konstant blieb. Daher gehen Wissenschaftler bei WAVE davon aus, dass nach so einem klaren Ergebnis, zusätzliche Untersuchungen an Tiermodellen eine Zeitverschwendung wären.
Das bedeutet nicht, dass diese Studien nicht sicher sind. Bevor irgendein Medikament an Menschen verabreicht wird, auch nur versuchsweise, muss es streng auf die Giftigkeit hin durch Tierversuche getestet werden. WAVE hat hierzu keine Veröffentlichungen vorgelegt, aber wir müssen davon ausgehen, dass die Versuche durchgeführt wurden, da die zuständigen Gesundheitsbehörden die beiden neuen Studien sonst nicht zugelassen hätten.
Wie sind die Studien organisiert?
Bei den WAVE-Studien handelt es sich offiziell um Studien der Phase 1/2a. Eine Phase-1-Studie dient der Überprüfung der Sicherheit und wird mit einer kleinen Gruppe von Teilnehmern durchgeführt. Eine Phase-2-Studie wird dann normalerweise an einer etwas größeren Gruppe durchgeführt und es sollen hier auch erste Nachweise gefunden werden, dass das Medikament wirkt. Im vorliegenden Fall, da es allen Beteiligten wichtig ist, keine Zeit zu vergeuden, hat WAVE einige Aspekte von Phase 1 und Phase 2 zusammengelegt. Es bedeutet, dass sie überprüfen werden, ob das Medikament giftig ist (Phase 1) und gleichzeitig, ob es eine Auswirkung auf einige Symptome der Huntington-Krankheit hat (Phase 2).
Ähnlich wie bei der laufenden Ionis-Studie, wird auch bei WAVE’s Studien das Medikament jeweils per Lumbalpunktion in die Gehirn-Rückenmarks-Flüssigkeit injiziert. Dabei ist es den Forschern auch möglich Proben zu entnehmen, um den Gehalt des schädlichen Huntingtins in der Gehirn-Rückenmarks-Flüssigkeit zu messen. Wir hoffen, dass WAVE dadurch wirklich herausfinden wird, dass sich die Menge des mutierten Huntingtins im Gehirn verringert.
Wie kann man an der Studie teilnehmen?
WAVE möchte zuerst 50 Teilnehmer weltweit pro Studie einbeziehen. Das ist eine geringe Zahl, aber wenn sich das Medikament als sicher herausstellt, wird man zu größer angelegten Studien übergehen, um die Wirksamkeit zu testen. Es ist geplant, in Kanada zu beginnen und dann auch Teilnehmer aus Europa und den USA mit einzubeziehen. Gesucht werden Teilnehmer von 18 Jahren und älter, die bereits Symptome zeigen. Zudem muss über einen genetischen Test festgestellt werden, ob einer der gesuchten SNPs vorliegt. Interessierte wenden sich am besten an ihren lokalen Huntington-Experten.
Was bedeutet das alles für die Huntington-Krankheit?
Wir hoffen alle, dass das Ionis ASO das erste Medikament ist, dass die Huntington-Krankheit verlangsamen oder gar aufhalten kann. Trotzdem ist es wichtig, zu beachten, dass es das erste Mal ist, dass diese Medikamente bei Menschen eingesetzt werden. Es kann sein, dass sie nicht wirksam sind, weil Schäden, die den Patienten bereits im früheren Leben zugefügt wurden, sich als irreparabel herausstellen. Es könnten weiterhin sein, dass beim Menschen Nebenwirkungen auftreten, die es bisher bei Mäusen nicht gab. Während WAVE’s Medikament die Menge des gesunden Proteins nicht beeinflussen sollte, könnte es mit anderen mRNAs interagieren und hier zu einer verringerten Proteinproduktion führen. Aber wir finden es sehr spannend und sind optimistisch bezüglich dieser Huntingtin-verringernden Medikamente und WAVE’s neueste Verfeinerung sieht nach einem tollen Fortschritt aus.


