
Fortschritte an vielen Fronten im Kampf gegen das Protein, das die Huntington-Krankheit verursacht
In diesem Herbst gibt es aufregende Ankündigungen von einer Reihe von Unternehmen, die sich auf neuartige Huntingtin-senkende Technologien konzentrieren, darunter Wave, PTC und Voyager

Wir haben eine Reihe aufregender Updates von Ionis und Roche/Genentech über ihr Programm zum Testen eines Medikaments erhalten, das die Produktion des Huntingtin-Proteins senkt – aber sie sind nicht mehr die einzigen Akteure. Kürzlich haben mehrere andere Akteure – darunter Wave Life Sciences, PTC Therapeutics und Voyager Therapeutics – große Ankündigungen zu ihren eigenen Huntingtin-senkenden Programmen gemacht. Es passiert viel, und HDBuzz ist hier, um all diese Ansätze zu entwirren.
Huntingtin-Senkung
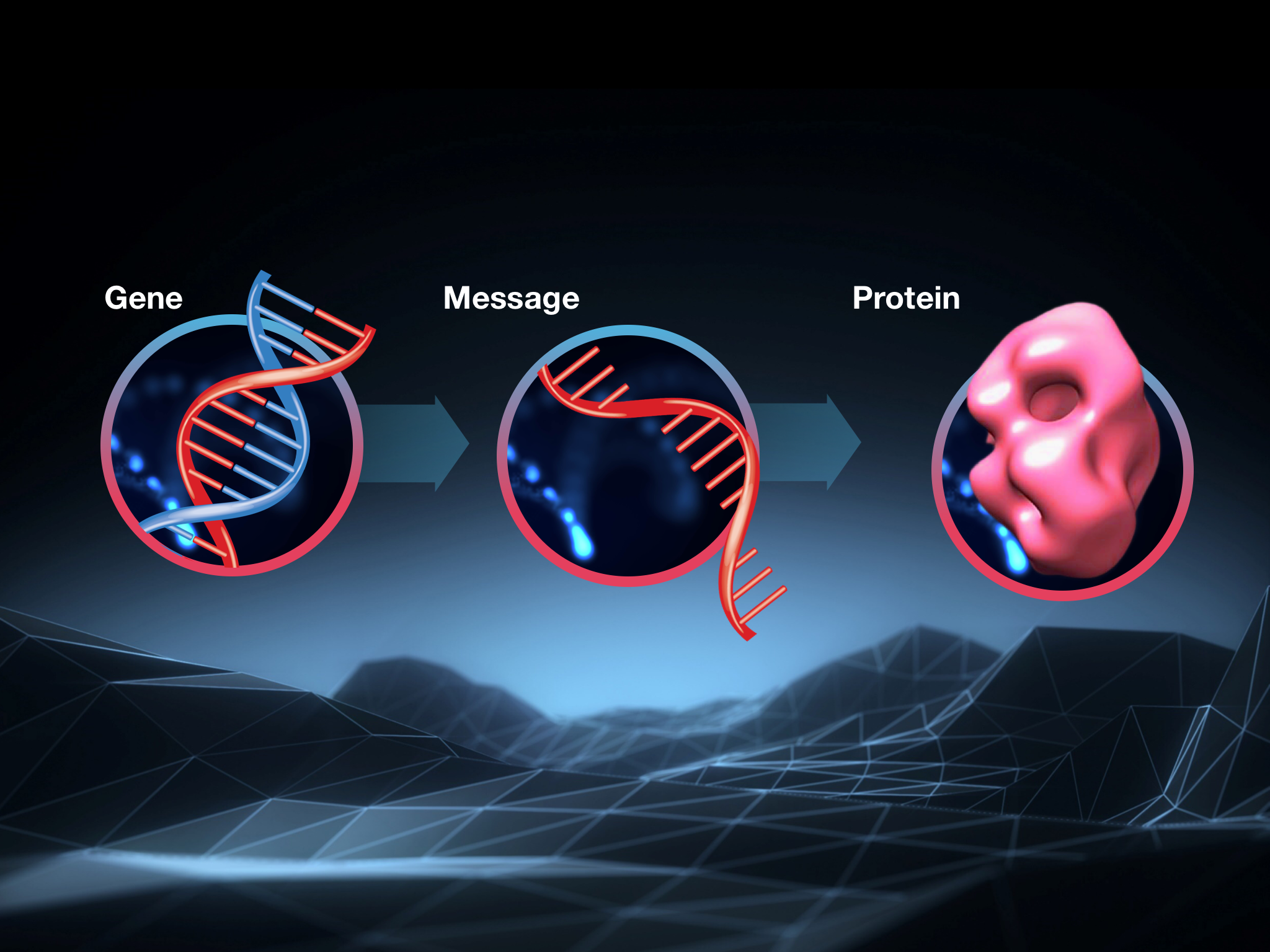
Das Ziel all dieser Ansätze ist es, die Menge an Huntingtin-Protein in Gehirnzellen zu senken. Das Huntingtin-Protein ist die kleine Maschine, die von Zellen hergestellt wird, wenn sie dem Bauplan im HD-Gen folgen. Es ist das mutierte Huntingtin-Protein, nicht die Mutation in der DNA, von dem die meisten Forscher glauben, dass es die Funktionsstörung der Gehirnzellen verursacht, die HD verursacht.

Eine kurze Erinnerung daran, wie dieser Prozess funktioniert, ist angebracht, bevor wir eintauchen. Zellen folgen Anweisungen in der DNA, aber sie verwenden sie nicht direkt, um ein Protein herzustellen: Sie kopieren die Anweisungen in der DNA in eine Art Entwurfskopie der genetischen Information, die aus einer eng verwandten Chemikalie namens RNA hergestellt wird. Wissenschaftler nennen diese Entwurfskopie Boten-RNA oder kurz mRNA.
Die Anweisungen im HD-Gen in unserer DNA werden also in Boten-RNA kopiert, die dann von der Zelle interpretiert wird, um das Huntingtin-Protein aufzubauen. Ein bisschen verwirrend, aber es funktioniert!
Wenn Sie sich nur an eines erinnern, dann erinnern Sie sich daran: Eine Unterbrechung der Kette an irgendeiner Stelle verhindert, dass Zellen das Huntingtin-Protein herstellen. In Tierstudien führte die Senkung des Huntingtin-Proteins zu großen Verbesserungen der HD-ähnlichen Symptome.
Dieser Ansatz zur HD-Therapie wird als Huntingtin-Senkung bezeichnet und steckt hinter dem Ionis/Roche-Programm und der bevorstehenden großen Phase-3-Studie. Kürzlich haben jedoch mindestens drei weitere Unternehmen aufregende Fortschritte bei verschiedenen Huntingtin-senkenden Ansätzen angekündigt.
Waves gezielter Ansatz
„Waves Ansatz zielt auf winzige genetische Unterschiede zwischen den gesunden und mutierten HD-Genen außerhalb des krankheitsverursachenden CAG-Abschnitts ab. Diese geringfügigen Unterschiede in der Schreibweise sind Teil der normalen menschlichen genetischen Variation und scheinen keine Auswirkungen auf die HD-Symptome zu haben. Aber die winzigen Unterschiede in der Schreibweise bieten ein Ziel für ein ASO, das zwischen der normalen HD-Botschaft und der mutierten unterscheiden kann.“
Zuerst kommen nicht eine, sondern zwei Studien von Wave Life Sciences. Wir haben hier über Waves Ansatz geschrieben. Wie das Medikament von Ionis/Roche/Genentech, das derzeit an HD-Patienten getestet wird, basiert Waves Technologie auf Antisense-Oligonukleotiden (ASOs) – kleinen, stark modifizierten DNA-Stückchen, die in Zellen eindringen, spezifische Boten-RNAs finden und diese zerstören.
Wie in der Ionis/Roche-Studie zielt Wave darauf ab, die Huntingtin-Botschaft zur Zerstörung zu bringen, in der Hoffnung, die HD-Symptome zu verbessern. Aber Wave verfolgt einen etwas anderen Ansatz. Denken Sie daran, dass fast jeder HD-Patient ein mutiertes HD-Gen und eine normale Kopie hat. Das Medikament von Ionis/Roche zielt auf beide Kopien ab und reduziert letztendlich den Spiegel sowohl des normalen als auch des mutierten Huntingtin-Proteins im Gehirn.
Waves Ansatz zielt auf winzige genetische Unterschiede zwischen den gesunden und mutierten HD-Genen außerhalb des krankheitsverursachenden CAG-Abschnitts ab. Diese geringfügigen Unterschiede in der Schreibweise sind Teil der normalen menschlichen genetischen Variation und scheinen keine Auswirkungen auf die HD-Symptome zu haben. Aber die winzigen Unterschiede in der Schreibweise bieten ein Ziel für ein ASO, das zwischen der normalen HD-Botschaft und der mutierten unterscheiden kann.
In einer perfekten Welt ist es natürlich besser, nur auf das mutierte HD-Gen abzuzielen. Das normale HD-Gen hat eine Reihe wichtiger Funktionen in Zellen, von denen wir nicht alle perfekt verstehen. Wenn es genauso einfach wäre, nur die mutierte Kopie zu entfernen, sollten wir das tun.
Es gibt jedoch immer einen Kompromiss. Für die Huntingtin-Senkung besteht der Kompromiss darin, dass nicht jeder HD-Patient für die von Wave entwickelten ASOs in Frage kommt. Damit ihr Ansatz funktioniert, muss eine Person die HD-Mutation und auch eine der genetischen Unterschiede in der Schreibweise geerbt haben, auf die die Medikamente abzielen.
Wave hat Studien in HD-Kliniken durchgeführt und gezeigt, dass bis zu etwa zwei Drittel der HD-Patienten für eine Behandlung mit einem der beiden von ihnen entwickelten ASOs geeignet sein könnten. Jedes dieser Medikamente zielt auf eine andere genetische Variation ab, und die Tatsache, dass es zwei Medikamente gibt, ermöglicht es ihnen, ihren Ansatz bei einem größeren Teil der HD-Population anzuwenden.
Sie testen die Sicherheit dieser ersten beiden mutierten Huntingtin-senkenden ASOs bei HD-Patienten in Kanada, Europa und den USA. Wie bei der ersten Ionis/Roche-Studie ist das Ziel dieser Studien, festzustellen, ob diese Medikamente sicher sind. Wenn dies der Fall ist, würden sie anschließend in größeren Studien auf ihre Fähigkeit getestet, die HD-Symptome zu verbessern.
Wir haben kürzlich auch von Wave gehört, dass sie hinter den Kulissen an einem weiteren ASO arbeiten, das auf eine weitere Variation im HD-Gen abzielt. Dieses dritte Medikament wird noch nicht an Menschen getestet, bietet aber zusätzliche Hoffnung für Personen, die für keines der bestehenden Wave-Medikamente in Frage kommen. Im Jahr 2019 hoffen wir, vorläufige Updates zu den Studien zur Sicherheit am Menschen aus den ersten beiden Wave-Studien sowie weitere Details zu ihrem Programm zur Entwicklung eines dritten ASO zu hören.
Was ist das P-T-C?
Es gibt nicht nur ASOs in der Welt der Huntingtin-Senkung. Auf dem Treffen des European Huntington’s Disease Network in Wien in diesem Herbst informierte Anu Bhattacharyya von PTC Therapeutics das EHDN-Publikum über aufregende Fortschritte in ihrer Firma, die ebenfalls an der Huntingtin-Senkung als Behandlung für HD interessiert ist.
„PTC entwickelt das, was Forscher als kleines Molekül bezeichnen, also ein Medikament, das hoffentlich als Pille eingenommen werden kann, um den Spiegel der Huntingtin-Boten-RNA zu senken. Vor einigen Jahren hätte dies wie Science-Fiction gewirkt, aber mehrere Unternehmen haben experimentelle Medikamente beschrieben, bei denen dieser Ansatz zu funktionieren scheint.“
Der von PTC verfolgte Ansatz ist völlig anders als der ASO-Ansatz von Wave und Ionis/Roche. Alle anderen Programme beinhalten Injektionen in das Gehirn oder die Wirbelsäule – lohnenswert, wenn sie funktionieren, aber viel invasiver, als wir es uns letztendlich wünschen würden. PTC entwickelt das, was Forscher als kleines Molekül bezeichnen, also ein Medikament, das hoffentlich als Pille eingenommen werden kann, um den Spiegel der Huntingtin-Boten-RNA zu senken. Vor einigen Jahren hätte dies wie Science-Fiction gewirkt, aber mehrere Unternehmen haben experimentelle Medikamente beschrieben, bei denen dieser Ansatz zu funktionieren scheint.
PTC ist führend unter den Unternehmen, die diesen neuen Ansatz zur Beeinflussung spezifischer Boten-RNAs entwickeln, und sie haben HD im Visier. Sie haben ein Medikament entwickelt, das den Spiegel des Huntingtin-Proteins in Zellen reduziert. Zum ersten Mal enthüllte Bhattacharyya auf der EHDN, dass diese Medikamente auch im Gehirn lebender Mäuse wirken – was darauf hindeutet, dass die Medikamente vom Magen ins Gehirn gelangen, was eine große Leistung ist.
Besonders cool daran ist, dass selbst wenn ein als Pille eingenommenes Medikament Huntingtin im Gehirn um einen geringeren Betrag reduziert als ein injiziertes Medikament, es dennoch sehr nützlich sein könnte. Eine Huntingtin-senkende Pille könnte bedeuten, dass spinale Injektionen eines stärkeren Medikaments beispielsweise alle sechs oder zwölf Monate erforderlich sind, anstatt alle ein oder zwei Monate.
Das Programm von PTC befindet sich in einer früheren Phase als die Programme von Ionis/Roche und Wave, da es noch an Tieren getestet wird. Aber es ist ein wirklich aufregender Ansatz, der echte Vorteile bieten könnte, wenn er sich in zukünftigen Studien als sicher und wirksam erweist. Und PTC scheint für die Zukunft zu planen – Bhattacharyya teilte dem Publikum auf der EHDN mit, dass PTC das Ziel habe, im Jahr 2020 mit Sicherheitsstudien am Menschen zu beginnen. Aufregenderweise hat PTC eine Erfolgsbilanz mit zwei zugelassenen oralen Medikamenten gegen Muskeldystrophie, einer weiteren genetischen neurologischen Erkrankung.
Voyager
Auf einer anderen Konferenz in diesem Herbst – dem Kongress der European Society of Gene and Cell Therapy – erhielten wir ein weiteres aufregendes Huntingtin-senkendes Update von Voyager Therapeutics. Voyager ist ein Biotechnologieunternehmen, das sich auf die Verwendung von Gentherapie zur Behandlung von Gehirnerkrankungen, einschließlich Huntington, konzentriert.
Die Gentherapie funktioniert ganz anders als ASOs oder niedermolekulare Medikamente. Die Gentherapie beruht auf winzigen, harmlosen Viren, um neue genetische Informationen in Zellen – in diesem Fall Gehirnzellen – zu transportieren. Viren sind sehr gut darin, sich in Zellen einzuschleichen, daher haben clevere Forscher herausgefunden, wie man sie dazu bringt, nützliche Dinge in verschiedene Zellen des Körpers zu transportieren.
In diesem Fall hat das Forscherteam von Voyager kundenspezifische Viren entwickelt, die Anweisungen liefern, die Gehirnzellen anweisen, ein spezielles RNA-Stück herzustellen, das die Huntingtin-mRNA aufspürt und zerstört. Tatsächlich programmiert das Virus Zellen um, um zu Fabriken zu werden, die täglich ein Medikament herstellen, das wie die oben besprochenen ASOs wirkt.
Dieser Ansatz hat einen großen Vorteil, nämlich dass die Behandlung nur einmal verabreicht werden muss. Nach der Behandlung produziert die Gehirnzelle theoretisch unbegrenzt das Huntingtin-senkende Molekül. Wenn dies sicher und wirksam ist, wäre dies natürlich besser als monatliche Injektionen in die Rückenmarksflüssigkeit oder sogar die tägliche Einnahme einer Pille.
Es gibt jedoch einige potenzielle Nachteile bei diesem Ansatz. Erstens – es könnte sich in irgendeiner Weise als unsicher herausstellen, die wir in diesem Stadium nicht vorhersehen können. Und da die Behandlung nicht reversibel ist, müssen wir bei Gentherapiestudien besonders auf die Sicherheit achten. Zweitens, während es ziemlich einfach ist, diese gehackten Viren in die meisten Zellen in einem winzigen Mäusegehirn zu bekommen, ist es viel schwieriger, dies mit den 86 Milliarden Neuronen im menschlichen Gehirn zu tun.
„Das Forscherteam von Voyager hat kundenspezifische Viren entwickelt, die Anweisungen liefern, die Gehirnzellen anweisen, ein spezielles RNA-Stück herzustellen, das die Huntingtin-mRNA aufspürt und zerstört. Tatsächlich programmiert das Virus Zellen um, um zu Fabriken zu werden, die täglich ein Medikament herstellen, das wie die oben besprochenen ASOs wirkt.“
Das macht dieses Update von Voyager-Wissenschaftlern besonders interessant. Sie haben über Experimente berichtet, die an Affen durchgeführt wurden, die große, komplexe Gehirne haben, die unseren viel ähnlicher sind. Voyager hat chirurgische Techniken entwickelt, die dem Virus helfen, sich über sehr große Teile des Affengehirns auszubreiten, sowohl tiefe Gehirnstrukturen als auch die Hirnrinde – den faltigen äußeren Teil des Gehirns.
Dies ist ein besonders wichtiger Fortschritt, da die tiefen Gehirnstrukturen, auf die Voyager abzielt, von ASO-Medikamenten relativ schlecht erreicht werden, aber eine Schlüsselrolle bei HD spielen. Die Experimente von Voyager zeigen auch eine sehr gute Unterdrückung des Affen-Huntingtin-Gens – Reduktionen von etwa zwei Dritteln in tiefen Gehirnstrukturen und etwa einem Drittel in den äußeren, kortikalen Gehirnzellen. Dies sind anständige Reduktionen, und man könnte hoffen, dass das Erreichen ähnlicher Ergebnisse bei menschlichen HD-Patienten einige echte Vorteile bringen könnte.
Wie bei der Ionis/Roche-Studie besteht der von Voyager vorgesehene Weg darin, sowohl die mutierten als auch die normalen Kopien des HD-Gens zu reduzieren. Angesichts dessen und der Tatsache, dass ihre Therapie nach der Verabreichung nicht abgeschaltet werden kann, erfordert dieser Ansatz einen äußerst vorsichtigen Ansatz, den sie anscheinend mit all diesen Affenstudien verfolgen.
Fazit
In der HD-Community gibt es eine große und berechtigte Begeisterung für die laufende Studie von Ionis/Roche/Genentech. Jeder, einschließlich HDBuzz, unterstützt diese Studie und hat große Hoffnungen, dass sie den HD-Patienten einen gewissen Nutzen bringen wird. Aber wie diese jüngsten Fortschritte zeigen, ist dies nicht das einzige Spiel in der Stadt. Es gibt andere Ansätze zur Huntingtin-Senkung, die noch nicht ganz so weit fortgeschritten sind, aber große potenzielle Vorteile bieten.
Zusammenfassend lässt sich sagen: Es gibt zwei laufende Studienprogramme mit Huntingtin-senkenden ASOs bei Patienten. Eines zielt auf beide Kopien des HD-Gens ab (Roche/Genentech), hat den Sicherheitstest bestanden und wird bald auf Wirksamkeit getestet. Das andere zielt nur auf das mutierte Gen ab (Wave) und wird derzeit auf Sicherheit getestet. Dahinter haben wir Einzel-Gentherapiestudien, die umfangreiche Sicherheitsstudien durchlaufen, um sich auf Studien am Menschen vorzubereiten (Voyager und andere), und einen wirklich neuartigen Ansatz mit kleinen Molekülen (PTC).
Die Unterstützung mehrerer Chancen erhöht nicht nur die Wahrscheinlichkeit, dass eine erfolgreich ist – sie bietet auch die Chance, dass mehr als eine funktionieren könnte. Das bietet eine verlockende Zukunft, in der Kombinationen von Medikamenten eingesetzt werden könnten, um den maximalen Nutzen bei geringstmöglichem Risiko zu erzielen. Kombinationsansätze haben sich bei anderen Krankheiten wie HIV, Krebs und Diabetes als erfolgreich erwiesen. Wenn es um Medikamente in der Entwicklung und Medikamente, die wirken, geht, ist mehr mehr.
Mehr erfahren
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


