Spannendes neues Werkzeug zur Huntingtin-Senkung beschrieben
Spannende neue Arbeit zur Huntingtin-Senkung von @SangamoTx und @CHDIfoundation unter Verwendung von „Zinkfingern“, um die Expression des mutierten Huntingtin-Gens abzuschalten. Weitere Details zu dieser aufregenden neuen Technik finden Sie hier.

Ein aufregendes neues Werkzeug im Kampf gegen die Huntington-Krankheit wurde gerade beschrieben. Eine internationale Gruppe von Wissenschaftlern hat einen neuen, gezielten Weg entwickelt, um den Spiegel des mutierten Huntingtin-Proteins zu senken.
Huntingtin-Genetik: vom Gen zum Protein
Die Huntington-Krankheit (HD) wird durch eine genetische Veränderung – oder Mutation – in der DNA eines bestimmten Gens verursacht. Wissenschaftler nennen das Gen
Diese vier DNA-Buchstaben werden durch Abkürzungen für ihre chemischen Namen bezeichnet: ‚A‘, ‚C‘, ‚T‘ und ‚G‘. Jeder Fall von HD wird durch eine Verlängerung eines langen Abschnitts der DNA-Buchstaben ‚C-A-G‘ sehr nahe am Anfang des Huntingtin-Gens verursacht. Bei den meisten Menschen – denjenigen, die nicht dazu bestimmt sind, HD zu entwickeln – wird dieser ‚C-A-G‘-Code aus Gründen, die wir immer noch nicht vollständig verstehen, etwa 20 Mal wiederholt.
HD entsteht, wenn eine Person einen verlängerten Abschnitt von ‚C-A-G‘ erbt, wobei die Krankheit unweigerlich bei Menschen auftritt, die 40 oder mehr ‚C-A-G’s erben. Beachten Sie, dass jeder Mensch zwei verschiedene Kopien des Huntingtin-Gens hat – eine von der Mutter und eine vom Vater geerbt. Die überwiegende Mehrheit der HD-Patienten hat eine normale Kopie mit einer geringen Anzahl von ‚C-A-G’s und die mutierte Kopie, in der sie länger sind.
Die meisten Gene, einschließlich des Huntingtin-Gens, werden von Zellen als Bedienungsanleitungen für den Aufbau von Proteinen verwendet – winzige molekulare Maschinen, die den Zellen bei ihrer Arbeit helfen. In den Zellen von Menschen mit der HD-Mutation gibt es also zwei verschiedene Versionen des Huntingtin-Gens, und diese Anweisungen weisen die Zelle an, zwei verschiedene Versionen des Huntingtin-Proteins herzustellen.
Huntingtin-Senkung
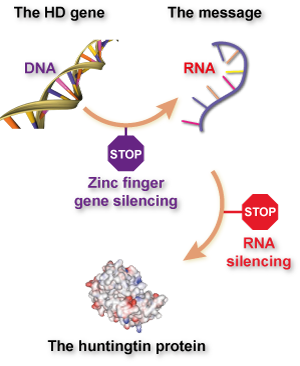
Ein Hauptziel der HD-Forschungswelt ist derzeit die Untersuchung, ob „Huntingtin-Senkungs“-Strategien wirksame Behandlungen für HD sein könnten. Das Ziel von Huntingtin-Senkungsbehandlungen ist es, die Geschwindigkeit zu stoppen oder zu verlangsamen, mit der Zellen die Informationen im Huntingtin-Gen nutzen, um das Huntingtin-Protein herzustellen.
Tierstudien deuten darauf hin, dass wir eine Hoffnung haben könnten, die Symptome von HD zu reduzieren, wenn wir die Menge an Huntingtin-Protein senken können, die aus dem mutierten Huntingtin-Gen hergestellt wird. Eine Reihe von Pharmaunternehmen verfolgen eine breite Palette von Ansätzen, um Huntingtin als potenziell neue Behandlungen für HD zu senken. Wir haben die allgemeine Idee der Huntingtin-Senkung hier behandelt, mit neueren Updates zu Huntingtin-Senkungsmedikamenten namens ASOs hier und hier sowie anderen Ansätzen hier und hier.
Und jetzt ZFPs
Das Biotechnologieunternehmen Sangamo Therapeutics arbeitet seit einigen Jahren an einer weiteren Möglichkeit, Proteine zu senken: indem es kontrolliert, ob ein Gen ein- oder aktiviert wird. Ihre Technologie basiert auf kleinen molekularen Maschinen, die als
Während die Grundidee die gleiche ist, funktionieren ZFPs im Vergleich zu bestehenden Huntingtin-Senkungstechnologien auf eine ganz einzigartige Weise. Bestehende Huntingtin-Senkungsmedikamente wirken, indem sie auf einen Zwischenschritt zwischen dem Ablesen der Informationen des Huntingtin-Gens aus der DNA und der Herstellung des Huntingtin-Proteins abzielen. Die Informationen in Genen werden zuerst aus der DNA abgelesen, in eine eng verwandte Sprache namens RNA kopiert und dann in die Sprache der Proteine übersetzt. Diese intermediäre RNA-Nachricht ist das Ziel von Huntingtin-Senkungsmedikamenten, die sich derzeit in der Klinik befinden.
Aber ZFPs, wie sie von Sangamo und ihren Mitarbeitern entwickelt wurden, funktionieren auf eine ganz andere Weise. Unsere Zellen enthalten eine Reihe von Proteinen, die winzige kleine Zangen enthalten, die genau richtig geformt sind, um bestimmte DNA-Sequenzen zu greifen. (Nerd-Alarm – die Zangen werden von einem Zinkatom zusammengehalten, was den lustigen Namen erklärt).
„Im Gegensatz zu Ansätzen, die auf die Huntingtin-RNA abzielen, schalten mit ZFPs behandelte Zellen ihr Huntingtin-Gen erst gar nicht ein.“
ZFPs für HD?
Seit vielen Jahren arbeiten Forscher daran, natürlich vorkommende ZFPs zu verstehen, in der Hoffnung, sie so umprogrammieren zu können, dass sie an neuen spezifischen DNA-Sequenzen haften bleiben. Sangamo war führend auf diesem Gebiet und hat eine Art Werkzeugkasten mit kundenspezifischen ZFPs entwickelt, die auf fast jede DNA-Sequenz abzielen können.
Warum das tun, was ist der Sinn, kundenspezifische DNA-bindende Zangen herzustellen? Nun, es stellt sich heraus, dass wir verschiedene Nutzlasten an diesen Zangen befestigen können, und einige von ihnen tun sehr interessante Dinge mit der DNA, an der sie befestigt sind. Als Beispiel wissen Forscher, dass sie eine Art zelluläres Stoppschild an Zinkfinger anbringen können, um die Zelle daran zu hindern, das Zielgen zu aktivieren.
Eine kürzlich veröffentlichte Publikation beschreibt die Arbeit von Sangamo zur Entwicklung von ZFPs für die Verwendung bei HD, die eine groß angelegte Zusammenarbeit mit der CHDI-Stiftung und einer Reihe von HD-Forschern auf der ganzen Welt war. Nach einer mühsamen Screening-Anstrengung konnten sie neue ZFPs entwickeln, die am Huntingtin-Gen – in der DNA – haften und seine Aktivierung blockieren. Im Gegensatz zu anderen Ansätzen, die auf die Huntingtin-RNA abzielen, schalten mit diesen ZFPs behandelte Zellen ihr Huntingtin-Gen erst gar nicht ein.
Noch besser ist, dass das Team ZFPs entwickeln konnte, die die Expression nur der mutierten Kopie des Huntingtin-Gens abschalten können, während die normale Kopie vollständig in Ruhe gelassen wird. Sangamo testete ihre Fähigkeit, zwischen einer der niedrigsten CAG-Größen, die HD beim Menschen verursachen (38 CAG-Wiederholungen), zu unterscheiden, während die normale Kopie von Huntingtin in Ruhe gelassen wurde.
Vielversprechende Ergebnisse bei Mäusen
Nachdem das Team in Zellen bewiesen hatte, dass ihre neuen ZFPs mutiertes Huntingtin spezifisch abschalten konnten, führte es als Nächstes eine Reihe von sehr gut durchgeführten Tierstudien durch, um zu sehen, ob ihr Werkzeug im Gehirn von Tieren mit HD-ähnlichen Mutationen nützlich sein könnte. Um umfassend zu sein, testeten sie zwei verschiedene Tiermodelle von HD – eines mit sehr schnell fortschreitenden Symptomen und ein anderes mit subtileren langfristigen Veränderungen.
In beiden Fällen führte die ZFP-Verabreichung an das Gehirn von Mäusen zu einer Reduktion des Huntingtin-Proteins. Es half auch bei einigen der Symptome, die diese Mäuse erfahren, die ein wenig wie Dinge aussehen, die wir bei HD-Patienten beobachten.
Es ist relativ einfach, experimentelle Medikamente wie dieses an Mäusen zu testen. Forscher können Hirngewebe von Tieren sammeln und es intensiv untersuchen, aber ähnliche Studien sind bei menschlichen HD-Patienten unmöglich, die ziemlich mürrisch werden, wenn man ihnen Stücke ihres Gehirns entnimmt. Da die Übertragung von Mausstudien auf den Menschen so schwierig ist, führte das Team eine weitere Reihe von Experimenten durch, um festzustellen, ob die ZFP-Behandlung die Dinge in einer Weise verbesserte, die wir auch bei Menschen messen können.
Tatsächlich konnte das Team mithilfe ausgefeilter Hirnscan-Techniken Vorteile der ZFP-Behandlung bei HD-Mäusen beobachten. Diese etablierten Techniken funktionieren auch beim Menschen, sodass wir bei der Prüfung von ZFPs in Humanstudien hoffen können, Verbesserungen zu sehen, ohne Gewebe entfernen zu müssen.

Was sind die Risiken und Vorteile von ZFPs?
Wie bei jeder anderen potenziellen Behandlung für HD gibt es Vorteile und Nachteile bei der Verwendung von ZFPs. Theoretisch ist es ein viel besserer Ansatz, die Proteinproduktion aus einem mutierten Gen vollständig abzuschalten, anstatt zu versuchen, die RNA und das Protein danach zu beseitigen. Wir verstehen nicht vollständig, welche RNA- und Proteinspezies toxische Wirkungen in Zellen haben, daher scheint das Abschalten am Hahn der beste Ansatz zu sein.
Darüber hinaus zeigen die von Sangamo und ihren Mitarbeitern präsentierten Daten eine sehr gute Fähigkeit, zwischen der normalen Kopie des Huntingtin-Gens und der mutierten Kopie zu unterscheiden. Nur die mutierte Kopie des Huntingtin-Gens stillzulegen und die andere Kopie zu schonen, ist theoretisch vorzuziehen, da wir immer noch nicht jedes Risiko kennen, das mit der Reduzierung der normalen Kopie verbunden ist.
Auf der anderen Seite sind die von Sangamo und ihren Mitarbeitern entwickelten ZFPs selbst Gene, die in DNA kodiert sind und an jede Zelle geliefert werden müssen, die wir behandeln wollen. Die Verwendung der Lieferung von Genen zur Behandlung einer Krankheit wird allgemein als Gentherapie bezeichnet. Um eine wirksame Behandlung für HD zu sein, erfordert die ZFP-Gentherapie bestimmte Eingriffe. Die DNA, die die ZFPs kodiert, muss in ein Virus verpackt und in das Gehirn injiziert werden.
Wie jedes Medikament könnten die von Sangamo und ihren Mitarbeitern entwickelten ZFPs unerwartete Folgen haben. In diesem Fall könnte die einfachste Sorge um ZFPs sein, dass sie versehentlich auf andere Gene – neben Huntingtin – abzielen, um sie zu senken. Das Team führte recht detaillierte Untersuchungen dieser Möglichkeit in Zellen durch, aber im Gehirn könnten die Dinge natürlich komplizierter sein.
Der beste Weg, um festzustellen, ob diese ZFPs so nützlich sind, wie wir hoffen würden, ist die Durchführung von Humanstudien. Um dies zu unterstützen, hat Sangamo eine Partnerschaft mit dem japanischen Pharmariesen Takeda geschlossen, der sicherlich über das Fachwissen und die Ressourcen verfügt, um solche Studien durchzuführen. Bleiben Sie auf HDBuzz auf dem Laufenden, um Ankündigungen über zukünftige Studien mit ZFPs bei HD-Patienten zu erhalten.
Fazit
Diese aufregende neue Studie liefert einen weiteren Pfeil in unserem Köcher, während wir die Huntingtin-Senkung in der Klinik angehen. Die Studie wurde sehr gut durchgeführt und versetzt uns in eine gute Position, um die Prüfung von ZFPs in klinischen Studien am Menschen in Betracht zu ziehen. Es ist sehr aufregend zu sehen, dass brillante Wissenschaftler auf der ganzen Welt weiterhin neue Ansätze zur Behandlung von HD entwickeln.
Diese neuen ZFPs scheinen wahrscheinlich aufregende Vorteile gegenüber anderen Huntingtin-Senkungsansätzen zu bieten, auf deren Prüfung bei HD-Patienten wir uns freuen. Bleiben Sie auf HDBuzz auf dem Laufenden, um weitere Berichte über Huntingtin-Senkungstherapien zu erhalten!
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


