
Huntington's Disease Therapeutics Conference 2019 – Tag 2
Neue Ansätze für den Sprung vom Labor zur Therapie am Menschen: Huntington's Disease Therapeutics Conference 2019 Tag 2

Dr. Jeff Carroll und Dr. Ed Wild berichten von der „Huntington’s Disease Therapeutics Conference“ – der größten jährlichen Zusammenkunft von Huntington-Forschern. Die Konferenz in diesem Jahr ist noch größer und aufregender als zuvor.
Lesen Sie über Tag 1 hier.
Fortgeschrittene Werkzeuge für die translatorische Forschung
Guten Morgen! Gerade beginnt der zweite Tag der jährlichen Huntington-Therapeutik-Konferenz in Palm Springs 2019. Der erste Abschnitt heißt heute „Fortgeschrittene Werkzeuge für die translatorische Forschung“.
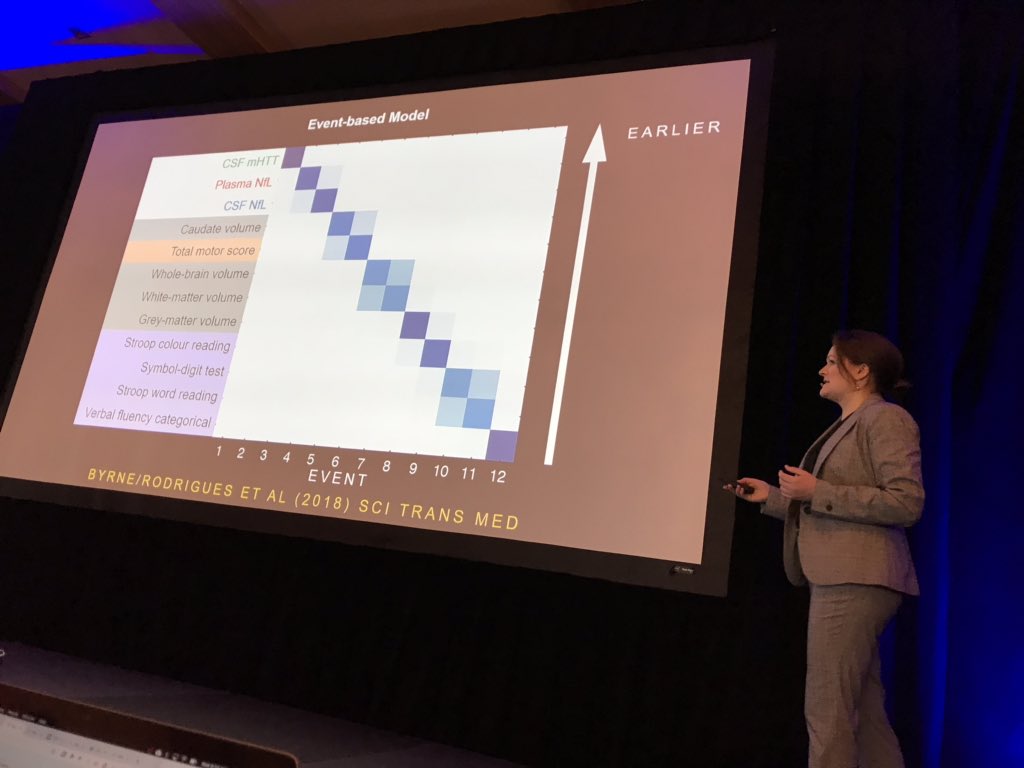
Als erste spricht Lauren Byrne vom University College London. Sie untersucht dort Biomarker im Blut und in der Gehirn-Rückenmarksflüssigkeit. Byrne maß mutiertes Huntingtin in diesem Nervenwasser sowie das Protein Neurofilament Light (NFL) in Blut und Nervenwasser. NFL ist ein Protein, das in Neuronen vorzufinden ist, und das von ihnen abgegeben wird, wenn sie beschädigt werden. Byrne nahm weiterhin MRT-Untersuchungen vor, um festzustellen, wie gut die Biomarker das Schrumpfen des Gehirns vorhersagen können. Überraschenderweise stellte sich dabei NFL als geeigneter heraus als das mutierte Huntingtin. Veränderungen des NFL-Gehaltes waren auch am frühesten messbar, früher als bildgebende Verfahren oder weitere klinische Untersuchungen überhaupt in der Lage waren, Veränderungen durch die Huntington-Krankheit zu erfassen.
Byrne hat gerade weitere Untersuchungen der Teilnehmer zwei Jahre später abgeschlossen. Das Ergebnis zeigt, dass sich der NFL-Gehalt wie erwartet mit der Zeit verändert. Zur Ermittlung der Werte kann ein neues Verfahren angewendet werden, bei dem auf vier Moleküle gleichzeitig getestet wird.
Als nächstes ist Amber Southwell von der University of Central Florida an der Reihe. Auch sie beschäftigt sich mit der Entwicklung von Verfahren, um mutiertes Huntingtin im Nervenwasser quantitativ erfassen zu können. Southwells Arbeitsgruppe war die erste, die den Nachweis erbrachte, dass Mäuse, die mit dem Huntingtin-Verminderungs-ASO von Ionis Pharma behandelt wurden, verringerte Konzentrationen von Huntingtin im Nervenwasser zeigen. Ein wichtiger Meilenstein auf dem Weg zur Anwendung beim Menschen.
Momentan führt Southwell Experimente mit Mäusen durch. Diese Mäuse weisen Huntingtin in bestimmten Arten von Gehirnzellen auf. So wollen die Forscher herausfinden, welche Gehirnzellen genau für die Freisetzung von Huntingtin in das Nervenwasser verantwortlich sind. Weiterhin führen sie Versuche durch, die darauf abzielen, zu verstehen, wie genau das Huntingtin aus den Gehirnzellen, die man Neuronen nennt, seinen Weg in das Nervenwasser findet. Ein Prozess names „glymphatisches System“ scheint dabei eine Rolle zu spielen.
Danach ist David Salzman von sRNAlytics an der Reihe. Seine Firma untersucht den Nutzen von RNA bei der Erforschung von Krankheiten. Zellen verwenden RNA für viele Funktionen, die bekannteste davon ist die Funktion als „Arbeitskopie“ der DNA. Hier spricht man auch von der Boten-RNA. Weniger bekannt ist, dass in den Zellen viele kleine RNA-Moleküle hergestellt werden, die bei der Regulation der Informationsübertragung durch die Boten-RNA helfen. Sie haben Namen wie „mikroRNA“ und es gibt eine Menge verschiedene davon. Gene sind als die Anleitung zur Herstellung von Proteinen mittlerweile recht gut verstanden, während die mikroRNAs noch viele Rätsel aufgeben.

SRNAlytics bestimmt Muster von kleinen Veränderungen in der RNA und verwendet künstliche Intelligenz, um festzustellen, aus welchem Körperteil sie stammen und wie sie sich in unterschiedlichen Krankheiten verändern. Ein Satz von 60 kleinen RNAs im Nervenwasser lässt scheinbar mit ausreichender Genauigkeit eine Unterscheidung zwischen Huntington-Krankheit, Alzheimer und Parkinson zu. Zwei kleine RNAs sind besonders interessant bei der Huntington-Krankheit, aber es muss noch genauer erforscht werden, welche Rolle sie in gesunden und erkrankten Gehirnen spielen, um ihren Wert als Biomarker herauszufinden.
Neue Tiermodelle
Guoping Feng vom Massachusetts Institute of Technology macht weiter. In seinem Labor wird an der Entwicklung neuer Primaten-Modelle für die Huntington-Krankheit gearbeitet. Auch wenn er sagt, dass Mäuse als Modell sehr nützlich sind, so haben sie doch nicht alle Gehirnregionen, die der Mensch hat und es sei daher nötig, auch mit weiter entwickelten Gehirnen zu forschen. In der Vergangenheit war es schwierig bis unmöglich beispielsweise Affen genetisch zu modifizieren, aber neue Genbearbeitungswerkzeuge lassen es zu. Mit Technologien wie CRISPR/Cas9 können präzise DNA-Veränderungen in Affenembryos vorgenommen werden. Auf diesem Gebiet ist Feng’s Labor eines der besten weltweit. Er sagt, dass sie von Kinderwunschzentren gelernt hätten, wie man die Affenbabies am gesündesten aufzieht. Sie haben ein neues Affenmodel für eine genetische Form von Autismus entwickelt. Das Verhalten dieser Affen ähnelt dem von Menschen mit Autismus, so zeigen sie zum Beispiel auch ein verändertes Sozialverhalten. Momentan befinden sie sich in der Entwicklung eines Modells für die Huntington-Krankheit. Sie haben bereits erste Versuche durchgeführt, die nahelegen, dass es funktionieren könnte.
Hideyuki Okano von der Keio Universität befasst sich ebenso mit Primaten-Modellen, genauer gesagt mit Krallenaffen. In seinem Labor wurden genetisch veränderte Krallenaffen aufgezogen, die eine Form von Parkinson haben. Wie bei menschlichen Parkinson-Patienten treten bei ihnen Symptome wie Schlafstörungen, Tremor und Schwierigkeiten beim Laufen auf. Die Ähnlichkeit zum Menschen ist ein gutes Argument für die Weiterentwicklung von Tiermodellen mit größeren Gehirnen. In Okano’s Labor werden gerade Techniken für die Züchtung eines Modells für die Huntington-Krankheit entwickelt.
Das wäre alles für heute. Den Bericht von Tag 1 finden Sie hier. In unserem nächsten Artikel berichten wir von Tag 3 der Konferenz.
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


