Huntington-Krankheit den Stinkefinger zeigen? Zwei Teams berichten über Erfolge für Zinkfinger-Medikamente in Zellen und Mäusen
Erfolg in Huntington-Krankheitszellen und -mäusen für Zinkfinger-Medikamente, die die Produktion des schädlichen Proteins reduzieren

Medikamente zu entwickeln, die unseren Zellen sagen, sie sollen weniger von dem schädlichen mutierten Huntingtin-Protein herstellen, ist einer der vielversprechendsten Ansätze zur Behandlung der Huntington-Krankheit. Die meisten bisherigen Versuche zur Huntingtin-Senkung haben versucht, eher den ‚Boten zu erschießen‘ als die Quelle der Nachricht anzugreifen – die DNA selbst. Nun haben zwei unabhängige Erfolgsmeldungen bei HD-Mäusen den ‚Zinkfinger‘-Medikamenten einen Schub gegeben – die direkt mit dem HD-Gen selbst interagieren. Es ist noch früh für diese neue Technologie: Was wissen wir, und welche Herausforderungen stehen bevor?
Was zum Teufel sind Zinkfinger?
Zink ist ein glänzendes Metall, das in ’silbernen‘ Münzen, Batterien und weißer Farbe vorkommt. Aber unser eigener Körper verwendet Zink für einen faszinierenden Zweck – von dem Forscher hoffen, ihn zu kapern, um die Huntington-Krankheit zu bekämpfen. Es hat sich herausgestellt, dass Zink von entscheidender Bedeutung ist, damit Zellen die Aktivitätsniveaus verschiedener Gene in unserer DNA kontrollieren können.
Denken Sie daran, dass ein Gen ein Satz von Anweisungen ist, der mit den chemischen ‚Buchstaben‘ A, C, G und T geschrieben ist. Jedes Gen hat eine andere Buchstabenfolge, und Zellen verwenden zinkhaltige Proteine, um einzelne Gene basierend auf ihrer spezifischen Buchstabenfolge zu steuern.
Wenn sich Zink mit einem gensteuernden Protein verbindet, bildet es ‚Zinkfingerproteine‘ – so genannt, weil sie in die enge Furche zwischen den beiden DNA-Strängen stechen und die Sequenz berühren können, für die sie gemacht sind.
Ein einzelner Zinkfinger kann je nach Anordnung der Zink- und Proteinbestandteile, aus denen er besteht, drei beliebige Buchstaben kitzeln. So könnte ein Zinkfinger an der Sequenz ‚ATG‘ haften, während ein anderer ‚CAG‘ bevorzugen könnte.
Das Aufregende daran ist, dass einzelne Zinkfinger in einer Sequenz miteinander verbunden werden können. Wenn man diese beiden zusammenfügt, erhält man ein Molekül, das an der 6-Buchstaben-Sequenz ATG-CAG haftet.
Designer-Finger
Nach jahrzehntelanger Arbeit zum Entschlüsseln und Verstehen der Funktionsweise von DNA und unseren Genen können Wissenschaftler heute synthetische Zinkfinger herstellen, die so konstruiert sind, dass sie an jede beliebige DNA-Sequenz binden.
Darüber hinaus können diese synthetischen Zinkfinger-Moleküle mit anderen Medikamenten optimiert und verpackt werden, um Mehrzweck-DNA-Bindungswerkzeuge herzustellen, die haften, schneiden, kleben und blockieren können.
Da die Huntington-Krankheit durch ein einzelnes fehlerhaftes Gen verursacht wird, ist sie ein guter Kandidat für die Zinkfinger-Medikamentenforschung.
Die Huntington-Krankheit tritt auf, wenn eine Person einen Rechtschreibfehler in dem Gen hat, das den Zellen sagt, wie ein bestimmtes Protein hergestellt werden soll – das Huntingtin genannt wird. Wenn eine Person zu viele CAGs hintereinander in der Nähe des Starts des Huntingtin-Gens hat, wird eine schädliche ‚mutierte‘ Form des Proteins basierend auf den Anweisungen im Gen produziert.
Blockierung des HD-Gens an seiner Quelle
Zwei Forschergruppen – ein akademisches Team aus Barcelona, Spanien, und ein Biotech-Unternehmen aus Kalifornien namens Sangamo – haben gerade erfolgreiche Experimente mit Zinkfinger-Medikamenten bekannt gegeben, die auf das Huntington-Krankheits-Gen abzielen.
Die Ergebnisse des spanischen Teams wurden kürzlich in der Fachzeitschrift PNAS veröffentlicht. Die Ergebnisse von Sangamo wurden auf dem jüngsten Treffen der Society for Neuroscience in New Orleans vorgestellt, wo HDBuzz im Publikum war.
Beide Teams entwarfen Zinkfinger-Moleküle, die an den ‚CAG-Trakt‘ des Huntingtin-Gens binden und den Zellen sagen würden, das Gen nicht zu lesen.
Die Zinkfingerketten wurden ausgewählt und verfeinert, um zu versuchen, sie so stark wie möglich an schädlich lange CAG-Strecken zu binden, ohne an normal lange Strecken zu binden. Das spanische Team nannte dies einprägsam einen ‚molekularen Maßband‘-Ansatz.
Nach ein wenig chemischem Herumbasteln testete jedes Team dann seine besten Zinkfinger-Rezepturen in Zellen, die in einer Petrischale wuchsen.
„Sobald ein Zinkfinger eine bestimmte DNA-Sequenz anvisiert hat, sind theoretisch viele aufregende Dinge möglich.“
Viral gehen
Leider können Wissenschaftler nicht einfach ein Zinkfinger-Medikament entwerfen und herstellen und es auf Zellen spritzen oder in eine Pille stecken. Da Zinkfinger-Medikamente Proteine sind, sind sie groß, komplex und zerbrechlich. Wenn das Medikament als Tablette geschluckt wird, würde es vom Verdauungssystem abgebaut.
Selbst wenn es als Injektion in das Blut verabreicht würde, würde das Zinkfingerprotein das Gehirn nicht erreichen, geschweige denn bis zum Zellkern unserer Neuronen gelangen, wo es sein muss, um seine Arbeit zu verrichten.
Um dieses Problem zu lösen, können Forscher Viren verwenden, um per ‚Anhalter‘ in den Zellkern zu gelangen.
Nachdem sie die gewünschte Zinkfinger-Proteinkette ausgewählt haben, ist es relativ einfach, eine DNA-Sequenz zu entwerfen, die den Zellen sagt, dass sie genau dieses Protein herstellen sollen. Diese DNA-Sequenz kann dann in Partikel eines Virus namens AAV gesteckt werden, der harmlos ist, aber Neuronen gut infizieren kann.
Wenn der Virus auf eine geeignete Zelle trifft, injiziert er seine DNA-Fracht in die Zelle und verwandelt die Zelle in eine Fabrik zur Herstellung des Zinkfinger-Medikaments!
Testen in Zellen
Das spanische Team verfeinerte seine besten Zinkfinger-Kandidaten in verschiedenen Arten von gentechnisch veränderten Zellen und Zellen, die aus der Haut von Huntington-Krankheits-Patienten gezüchtet wurden. Die Sangamo-Forscher verwendeten diese HD-Patientenzellen ebenfalls sowie Gehirnzellen aus einem HD-Mausmodell.
Die Zinkfinger-Medikamente beider Teams erfüllten die Aufgabe, die Aktivität von Genen mit langen CAG-Strecken zu reduzieren.
Off-Target-Effekte
Hier gibt es einen möglichen Haken. Das Huntingtin-Gen ist nicht das einzige mit einer langen CAG-Strecke – viele andere Gene haben das auch. Ein Medikament, das auf CAG-Trakte abzielt, könnte also auch diese Gene abschalten, was am Ende mehr schaden als nutzen könnte.
Eine Eigenart des Huntingtin-Gens könnte hilfreich sein, wenn es darum geht, diese ‚Off-Target-Effekte‘ zu vermeiden. Der CAG-Trakt im Huntingtin-Gen befindet sich zufällig sehr nahe am Start des Gens, wo die Wirkungen von Zinkfinger-Medikamenten am stärksten wirken.
Beide Gruppen führten Messungen durch, um festzustellen, ob andere Gene durch das Zinkfinger-Medikament beeinflusst werden, und fanden Ergebnisse, die im Großen und Ganzen beruhigend waren. Alle Auswirkungen waren gering im Vergleich zu der wünschenswerten Wirkung auf das mutierte Huntingtin-Gen.
Bringt die Mäuse herbei
Das spanische Team, das in seiner Arbeit etwas weiter fortgeschritten ist, brachte die Dinge auf die nächste Ebene, indem es seinen besten Zinkfinger-Kandidaten in einem Huntington-Krankheits-Mausmodell testete.
Sie gaben den Mäusen eine einzige Injektion in das Gehirn, die Viruspartikel enthielt, die mit DNA-Anweisungen zur Herstellung des Zinkfinger-Medikaments verpackt waren.
Die Aktivität des mutierten Huntingtin-Gens wurde im Gehirn in der Nähe der Injektionsstelle um etwa 50 % reduziert. Das Auftreten von Blobs des mutierten Huntingtin-Proteins wurde ebenfalls um etwa 40 % reduziert. Es gab keine Hinweise auf schädliche Auswirkungen wie Gewichtsverlust, aber die Studie war zu klein, um zu wissen, ob das Zinkfinger-Medikament die Symptome verbesserte.
Moment mal – ist das nicht nur Gen-Silencing?
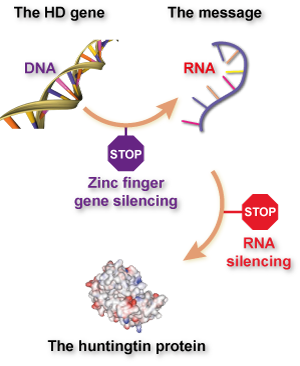
Wenn Sie hier über die Zinkfinger-Technologie gelesen haben und an ‚Gen-Silencing‘- oder ‚Huntingtin-Senkungs‘-Methoden zur Behandlung der Huntington-Krankheit erinnert werden, geben Sie sich einen Goldstern. Was diese Gruppen im Grunde versuchen, ist ‚Gen-Silencing‘, mit einem Twist – es zielt direkt auf die DNA ab, anstatt auf ein ‚Nachrichtenmolekül‘ namens RNA.
Bisher haben sich die meisten Versuche, die Huntingtin-Produktion zu senken, auf das RNA-Nachrichtenmolekül konzentriert, weil es einfacher ist, Medikamente zu entwickeln, die auf RNA abzielen als auf DNA. RNA schwimmt in Zellen in einem einzelnen Strang herum, während DNA in den Zellkernen versteckt ist. Darüber hinaus gibt es RNA-Silencing-Medikamente schon länger, und einige müssen nicht in Viruspartikel verpackt werden.
Da RNA-basierte Gen-Silencing-Medikamente bisher erfolgreich waren, warum sollte man sich mit der größeren Herausforderung befassen, die DNA des Huntingtin-Gens selbst anzuvisieren, insbesondere wenn dies bedeutet, dass man sich mit Viruspartikeln und großen, zerbrechlichen Medikamenten aus Protein auseinandersetzen muss? Es ist eine berechtigte Frage, und es gibt drei Hauptantworten.
Die erste hat mit dem Ursprung der Huntington-Krankheit zu tun. Wir wissen mit Sicherheit, dass die Mutation im Huntingtin-Gen der letztendliche Grund dafür ist, warum Menschen HD bekommen. Die DNA mit Zinkfingern anzugreifen bedeutet, die bekannte Ursache der Krankheit zu bekämpfen. Während RNA ein wesentlicher Schritt bei der Herstellung des mutierten Proteins ist, ist sie einen Schritt von der eigentlichen Ursache entfernt. Zinkfinger-Enthusiasten glauben, dass es sich lohnt, die zusätzlichen Hürden bei der Entwicklung von DNA-gerichteten Medikamenten zu überwinden, weil die Chance besteht, dass das Endergebnis sicherer und wirksamer sein könnte.
Die zweite betrifft RNA. Traditionell haben Biologen angenommen, dass RNA nicht direkt nützliche oder schädliche Dinge tut – sie sitzt einfach da, trägt Informationen und wird von zellulären Maschinen gelesen. Wir wissen jedoch jetzt, dass es mehr als das gibt, und es gibt mehrere genetische Krankheiten, bei denen die RNA direkt giftig für Zellen ist, anstatt einfach eine schädliche Botschaft zu tragen.
Während sich alle einig sind, dass das mutierte Huntingtin-Protein die Hauptursache für Schäden bei der Huntington-Krankheit ist, glauben einige Forscher, dass Huntingtin-RNA eine zusätzliche Schadensquelle sein könnte. Andere sind anderer Meinung, aber wenn die RNA schädlich sein könnte, scheint es ideal, zu verhindern, dass sie hergestellt wird, anstatt sie danach loszuwerden.
Der letzte Grund ist, über das Silencing hinauszugehen. Zinkfinger können mehr als nur die Genaktivität reduzieren. Sobald ein Zinkfinger eine bestimmte DNA-Sequenz anvisiert hat, sind theoretisch viele aufregende Dinge möglich.
Wenn man viele Jahre in die Zukunft denkt, ist es möglich, dass Zinkfinger verwendet werden könnten, um molekulare Scheren und Klebstoff zu dem mutierten HD-Gen zu lenken und die unerwünschten CAG-Wiederholungen ‚herauszuschneiden‘. Das ist als Genom-Editierung bekannt, und es ist einer der Ansätze, an deren Verfolgung Sangamo und andere interessiert sind.
Vor- und Nachteile
Die meisten HD-Forscher, mit denen wir sprechen, sagen, dass Zinkfinger als eine Möglichkeit zur Behandlung der Huntington-Krankheit „ziemlich cool“ sind, und wir sind geneigt, zuzustimmen. HD auf DNA-Ebene zu bekämpfen, der eigentlichen Ursache des Problems, ist definitiv etwas, das wir versuchen sollten, und wir sind froh, dass nach nur kurzer Zeit von zwei Gruppen unabhängig voneinander Fortschritte gemeldet wurden.
Es ist wichtig zu bedenken, dass es lange dauern wird, diese Techniken zu verfeinern, die sich noch früh in der Pipeline der Medikamentenentwicklung befinden – und Dinge wie die Genom-Editierung werden Jahrzehnte dauern, bis sie für HD-Patienten Früchte tragen.
In der Zwischenzeit sind alle in HD weiterhin begeistert von den laufenden Bemühungen auf der ganzen Welt, die Huntingtin-Spiegel zu senken, indem sie auf die RNA abzielen. Diese Techniken sind viel weiter fortgeschritten und sollten sehr bald in klinische Studien am Menschen eintreten.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


