
ASO-Gen-Silencing reicht weiter, hält länger an
Die Stilllegung des Huntingtin-Gens mittels ASO-Medikamenten reicht weiter, hält länger an und ist sicher. Bald eine klinische Studie am Menschen?
Medikamente, die als Antisense-Oligonukleotide oder ASOs bezeichnet werden, sind eine Methode, das Gen, das die Huntington-Krankheit verursacht, stillzulegen. Eine neue Veröffentlichung in der Fachzeitschrift Neuron deutet darauf hin, dass die ASO-Gen-Stilllegung im Gehirn weiter reicht als andere Methoden, länger anhält und sicher ist.
Wir haben gespannt auf Entwicklungen im Bereich des Gen-Silencing gewartet und waren daher hocherfreut, eine wichtige neue Forschungsarbeit zu lesen, die heute in der renommierten Fachzeitschrift Neuron veröffentlicht wurde. Eine Forschergruppe unter der Leitung von Dr. Don Cleveland an der University of California San Diego hat in Zusammenarbeit mit den Pharmaunternehmen Isis Pharmaceuticals, Genzyme und Novartis Antisense-Oligonukleotide (ASOs) für die Huntington-Krankheit entwickelt. Was haben sie also unternommen und was haben sie herausgefunden?
Genetik im Überblick

Bildnachweis: www.biocomicals.com von Alper Uzun, PhD
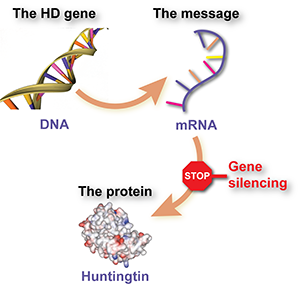
Das Huntington-Krankheitsgen ist nur eines von etwa 25.000 Genpaaren, die aus DNA bestehen und den Code zur Herstellung von Proteinen tragen; den Bausteinen für die Zellen, aus denen unser Körper besteht. Es gibt einige Schritte zwischen dem DNA-‚Code‘ und dem fertigen Protein. Einer dieser Schritte beinhaltet Boten-RNA oder mRNA.
Das HD-Gen ist der Code, der bei der Übersetzung HD-mRNA bildet. Es ist die mRNA, die einer Zelle sagt, wie sie das Huntingtin-Protein herstellen soll. Menschen mit Huntington-Krankheit haben eine normale Kopie und eine expandierte Kopie des Gens, sodass sie auch zwei verschiedene Arten von mRNA herstellen.
Seit der Identifizierung des HD-Gens vor fast 20 Jahren versuchen Wissenschaftler zu verstehen, was es bewirkt, wie es die Symptome der HD verursacht und wie man es effektiv ausschalten kann.
Das Gen ausschalten
Es gibt eine Reihe möglicher Methoden, das HD-Gen auszuschalten. Die vielleicht bekannteste ist die RNA-Interferenz, auch bekannt als RNAi oder manchmal siRNA.
Ein anderer Ansatz verwendet ein etwas anderes Molekül, das als Antisense-Oligonukleotide oder ASOs bezeichnet wird.
ASOs sind eine Art Kreuzung zwischen DNA und mRNA. Sie sind chemisch der DNA ähnlich, bestehen aber aus einem Einzelstrang wie mRNA. Wie andere Gen-Silencing-Medikamente sind sie darauf ausgelegt, an die HD-mRNA zu binden und der Zelle zu befehlen, diese zu zerstören, wodurch die Produktion des abnormalen Huntingtin-Proteins verhindert wird.
Die Theorie dahinter ist, dass, wenn man die Produktion des abnormalen Huntingtin-Proteins verhindert, man dessen schädliche Auswirkungen auf Zellen verhindert und somit Symptome reduziert oder verzögert.
In den letzten Monaten haben wir gute Nachrichten von mehreren Gruppen erhalten, die an RNAi-Medikamenten arbeiten, aber bis vor kurzem haben die ASO-Forscher nicht so viel veröffentlicht. Das hat sich mit dieser neuesten Veröffentlichung geändert, die uns über die harte Arbeit mehrerer Jahre auf den neuesten Stand bringt.
Klinische Studien am Menschen mit ASOs bei anderen neurologischen Erkrankungen haben bereits begonnen, aber die Situation bei HD wurde durch einige unbeantwortete Fragen verlangsamt.
Die Wirkung von ASOs
In dieser brandneuen Arbeit hat eine Gruppe cleverer Forscher die Auswirkungen der Verwendung von ASOs in 3 verschiedenen Mausmodellen der HD und auch in einem Affenmodell (das nächstbeste nach dem Menschen in Bezug auf Tiermodelle) untersucht, um Antworten auf eine Reihe verschiedener Fragen zu finden.
„ASOs behandeln Teile des Gehirns, die andere Gen-Silencing-Techniken nicht erreichen konnten“
Bei den Affen wurde das Medikament in die Rückenmarksflüssigkeit injiziert – ein viel weniger invasiver Eingriff als die Injektion ins Gehirn und einer, der für menschliche Patienten vorzuziehen wäre.
1. Was passiert, wenn man ein ASO infundiert, und wie lange hält es an?
Nun, sie infundierten die ASOs zwei bis drei Wochen lang in die Hirnventrikel (flüssigkeitsgefüllte Räume im Gehirn). Dies führte zu einer Verringerung der Spiegel des abnormalen Huntingtin-Proteins in vielen Bereichen, die im Gehirn als wichtig bekannt sind, einschließlich des Striatums, das bei der Huntington-Krankheit am stärksten betroffen ist. ASOs konnten sich im Gehirn viel weiter ausbreiten, als wir es bei RNAi-Medikamenten gesehen haben.
Zudem blieben die Spiegel lange Zeit niedrig – bis zu drei Monate nach Beendigung der Infusion.
2. Was geschah mit den Symptomen?
Forscher können die Symptome von Tiermodellen mithilfe von Tests überwachen, die Bewegungen und Verhalten messen. Die mit ASOs behandelten Tiere zeigten eine Verbesserung im Vergleich zu ihren unbehandelten Artgenossen. Noch besser: Die Verbesserung hielt lange an – und nicht nur, solange die Proteinspiegel niedrig blieben. Die Symptome waren auch einige Monate, nachdem die Spiegel des abnormalen Huntingtin-Proteins auf das Niveau vor der Behandlung zurückgekehrt waren, immer noch besser.
Dies unterstützt die Vorstellung, dass das Gehirn möglicherweise nur wenig Unterstützung benötigt, um die Auswirkungen des HD-Gens zu überleben. Ein prominenter HD-Forscher, Carl Johnson, prägte den Begriff ‚Huntingtin-Urlaub‘, um anzudeuten, dass eine kurze Pause von dem schädlichen Protein alles sein könnte, was nötig ist, um das Gleichgewicht zugunsten der Genesung zu verschieben.
3. Wann ist der beste Zeitpunkt für eine Behandlung?
Diese Studie deutet darauf hin, dass eine frühe Behandlung wahrscheinlich besser ist.
Motorische Symptome in einem bestimmten Mausmodell verbesserten sich innerhalb eines Monats nach Behandlungsbeginn und verbesserten sich weiter, bis die HD-Mäuse keinen Unterschied zu normalen Mäusen zeigten. Verhaltenssymptome normalisierten sich innerhalb von 2 Monaten nach Behandlungsbeginn.
Als ältere Mäuse mit mehr Symptomen behandelt wurden, verbesserten sich ihre motorischen und Verhaltenssymptome, aber es dauerte viel länger, bis Verbesserungen sichtbar wurden, und sie erholten sich nicht so stark wie die jüngeren, gesünderen Mäuse.
4. Was passiert, wenn man die ’normale‘ HD-mRNA blockiert?
Dies ist eine der Hauptfragen, die uns davon abhält, Studien zur Huntington-Krankheit zu beginnen. Wir wissen, dass das Huntingtin-Protein für die frühe Entwicklung unerlässlich ist, da Mausembryonen, die so manipuliert wurden, dass sie kein Huntingtin produzieren, vor der Geburt sterben. Ist es sicher, die Produktion sowohl des normalen als auch des abnormalen Huntingtin-Proteins bei Erwachsenen auszuschalten?
Dank dieser Arbeit und der Arbeit anderer Gen-Silencing-Forscher kommen wir einer Antwort näher. Das Ausschalten der normalen HD-mRNA für bis zu 3 Monate bei gesunden Affen wurde gut vertragen. In den Tiermodellen der HD änderte das Ausschalten sowohl der normalen als auch der abnormalen mRNA das Ausmaß der Genesung nicht und hatte keine negativen Auswirkungen.
Der einzige mögliche Knackpunkt ist nun, dass Menschen möglicherweise empfindlicher auf weniger Huntingtin reagieren als jedes Tier, an dem wir die Medikamente testen könnten. Nur eine Studie mit Patienten wird uns das mit Sicherheit sagen können.
Das sind alles gute Nachrichten
Wir haben nun den Beweis, dass ASOs Teile des Gehirns behandeln, die andere Gen-Silencing-Techniken nicht erreichen konnten. Darüber hinaus reichte eine kurzfristige Infusion mit ASOs aus, um das Fortschreiten der Symptome in Tiermodellen der Huntington-Krankheit zu verzögern. Und die Umkehrung der Symptome hält viel länger an als erwartet, selbst nachdem die Spiegel des abnormalen Huntingtin-Proteins wieder normal sind.
Was passiert als Nächstes?
Wir wissen, dass Menschen, die das expandierte HD-Gen tragen, viele Jahre lang vollkommen gesund bleiben können, obwohl sie von Geburt an das abnormale Huntingtin-Protein produzieren.
Vielleicht reicht eine einmalige Behandlung mit ASOs oder eine Behandlung einmal im Jahr aus, um die ‚Krankheitsuhr zurückzusetzen‘, indem die Produktion des Huntingtin-Proteins lange genug blockiert wird, damit die Zellen die Ansammlung beseitigen können. Die nächste Phase der Forschung dieser Gruppe wird darin bestehen, zu untersuchen, wie lange eine einzelne ASO-Injektion wirken wird.
Diese Arbeit deutet auch darauf hin, dass eine Infusion in die Rückenmarksflüssigkeit für ASO-Medikamente ausreichend sein könnte. Das ist zwar kein Spaziergang, aber im Vergleich zum Anbringen von Schläuchen und Pumpen, um Medikamente direkt ins Gehirn zu bringen, relativ unkompliziert.
Wir müssen auch herausfinden, wie viel ASO benötigt wird, um eine Wirkung beim Menschen zu erzielen, wann und wie lange es verabreicht werden sollte, und auf unerwartete Nebenwirkungen vorbereitet sein.
Aber es scheint, dass wir uns immer näher an klinische Studien zum HD-Gen-Silencing beim Menschen heranwagen. Und da mehrere verschiedene Gruppen alle kurz vor Studien stehen und darauf brennen, ihre Medikamente als Erste an Patienten zu testen, ist es wirklich eine aufregende Zeit für das Gen-Silencing bei HD.
Mehr erfahren
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


