
Doppelter Erfolg für das Huntingtin-RNAi-Gen-Silencing
Zwei gute Nachrichten für das RNAi-Gen-Silencing bei HD: Es ist über sechs Monate sicher und es gibt eine Methode, größere Hirnbereiche zu behandeln

Die meisten HD-Forscher sind ziemlich begeistert von der Idee, das Huntington-Krankheitsgen zu ’silencen‘, um die Produktion des schädlichen Huntingtin-Proteins zu reduzieren. Zwei Herausforderungen – Sicherheit und Verabreichung – sind dank der Zusammenarbeit von akademischen und industriellen Forschern nun näher an einer Lösung.
Wir sind große Fans des Gen-Silencing. Wie viele Huntington-Krankheitsforscher glauben wir, dass dies der Ansatz ist, der am ehesten eine wirksame Behandlung für HD hervorbringen wird.
Gen-Silencing beinhaltet die Verwendung eines speziell entwickelten Medikaments, um ein Botenmolekül, genannt RNA, abzufangen, das aus dem HD-Gen produziert wird und den Zellen befiehlt, das schädliche Huntingtin-Protein herzustellen. Die Wirkung des Medikaments ist, dass die Zellen weniger von dem Protein herstellen.
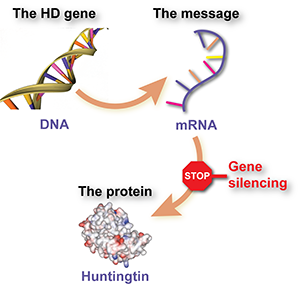
Noch einfacher ausgedrückt, ist Gen-Silencing wie ein Stoppschild für mutiertes Huntingtin.
Rasche Fortschritte
Bisher hat das Gen-Silencing für HD, in verschiedenen Formen, jede Hürde genommen, die es zu überwinden galt. Es wurde nun in mehreren Maus- und Rattenmodellen von HD getestet und hat nicht nur das Fortschreiten verlangsamt, sondern tatsächlich eine Verbesserung sowohl der Symptome als auch der Hirnschäden bewirkt. Es scheint, dass sich das Gehirn tatsächlich – bis zu einem gewissen Grad – erholen kann, wenn nur die Spiegel des schädlichen Proteins etwas gesenkt werden können.
Die verbleibenden Hürden
Mehrere Forschungsteams steuern auf Humanstudien zum Gen-Silencing bei HD zu. Doch es gibt noch einige Herausforderungen, die angegangen werden müssen, bevor dies geschehen kann.
Die erste ist die Sicherheit. Unerwartete Nebenwirkungen sind immer möglich und könnten dramatisch sein, da wir über Medikamente sprechen, die direkt in das Nervensystem injiziert oder infundiert werden und direkt mit der genetischen Maschinerie unserer Zellen interagieren.
Eine weitere ist die Verabreichung. Gen-Silencing-Medikamente können nicht als Pillen oder Injektionen ins Blut verabreicht werden, da sie nicht ins Gehirn gelangen würden. Sie müssen also direkt in das Nervensystem eingebracht werden. Je nach Struktur des Medikaments bedeutet dies eine Operation, um Nadeln oder Schläuche entweder in die Wirbelsäule oder den Schädel einzuführen. Das klingt drastisch, aber wenn die Behandlung wirksam ist, wird es sich lohnen.
Das Verabreichungsproblem hört hier jedoch nicht auf, denn sobald das Medikament im Kopf ist, muss es in unsere Gehirnzellen gelangen, um seine genetische Magie zu entfalten.
Das Gen-Silencing-Menü
Forscher im Bereich Gen-Silencing müssen mehrere Entscheidungen treffen, bevor sie eine Behandlungsstudie beginnen. Hier ist eine Checkliste, die dir hilft, zukünftige Nachrichten zu verstehen.
Zuerst müssen wir uns für die Struktur des Medikaments entscheiden. Die beiden grundlegenden Optionen sind RNAi-Medikamente, die chemisch den RNA-Botenmolekülen des Körpers ähneln; und ASO-Medikamente, die sich geringfügig unterscheiden, aber möglicherweise besser von Zellen aufgenommen werden.
Die zweite Wahl ist, welches Ziel gewählt werden soll: beide Kopien des HD-Gens oder nur die mutierte. Beide zu targetieren – genannt
Die dritte Wahl ist das Zielgebiet – wohin soll das Medikament gelangen? RNAi-Medikamente verbreiten sich von Natur aus nicht weit, daher muss das Medikament direkt in die Hirnsubstanz verabreicht werden. Medikamente, die sich weiter ausbreiten, wie ASOs, könnten in die Flüssigkeit um das Gehirn oder, wenn wir Glück haben, an der Basis der Wirbelsäule infundiert werden.
Viertens müssen wir uns für die Verabreichung entscheiden. Wird das Medikament allein verabreicht, in einem Virus verpackt oder unter Druck gepumpt, um seine Ausbreitung im Gehirn zu erhöhen?
Die fünfte Wahl ist das Behandlungsschema. Sollten wir eine einmalige Behandlung durchführen oder das Medikament über Wochen oder Monate infundieren? Im Moment wissen wir nicht, wie lange die Wirkungen anhalten werden, daher muss dies durch den Vergleich verschiedener Schemata herausgefunden werden.
Wann immer du über Gen-Silencing-Forschung liest, ist es hilfreich, im Voraus herauszufinden, welche Option für jede dieser Entscheidungen gewählt wurde.
Drei auf einmal
Auf dem jüngsten HD-Weltkongress in Melbourne berichtete HDBuzz über spannende Präsentationen mehrerer Gen-Silencing-Forschungsgruppen. Im November brachten wir dir dann Neuigkeiten über die erste Sicherheitsstudie zum Huntingtin-Gen-Silencing mittels RNAi in einem Primatengehirn.
„Das RNAi-Medikament verbreitete sich weiter, als man es mit einfachen Injektionen erreichen würde. Tatsächlich viel weiter.“
Nun wurden zwei weitere wissenschaftliche Artikel veröffentlicht – jeder das Ergebnis einer Zusammenarbeit zwischen akademischen Forschern und Biotechnologieunternehmen. Beide Artikel betrafen das in Minneapolis ansässige Unternehmen Medtronic und das Team von Dr. Zheming Zhang an der University of Kentucky.
Sechsmonatige Sicherheit
Der November-Bericht über die RNAi-Sicherheit bei Primaten war eine recht kurze Studie – sechs Wochen. Die neue Studie von Medtronic und Zhangs Team, die im Journal Brain veröffentlicht wurde, wurde ebenfalls an Rhesusaffen durchgeführt, dauerte aber volle sechs Monate.
Schauen wir uns an, was die Forscher untersucht haben, unter Verwendung der obigen Checkliste:
-
Struktur: Dies war eine Studie mit einem RNAi-Medikament.
-
Ziel: Beide Kopien des Gens wurden targetiert – nicht-spezifisches Knockdown.
-
Zielgebiet: Die Hirnsubstanz – genauer gesagt das Striatum, das bei HD-Patienten früh betroffen ist.
-
Verabreichung: Das Medikament wurde in ein leeres Virus, genannt AAV2, verpackt.
-
Behandlungsschema: Eine einmalige Injektion an fünf Stellen auf jeder Seite des Gehirns
Es ist auch erwähnenswert, dass ’normale‘ Affen verwendet wurden, ohne expandierte Kopien des HD-Gens. Daher konnte diese Studie nur Proteinveränderungen und Sicherheit messen – sie kann keine Verbesserung bei Patienten vorhersagen.
Nach der Behandlung wurden die Affen sechs Monate lang beobachtet, wobei ihr allgemeiner Gesundheitszustand und ihre Bewegungskontrolle untersucht wurden. Der Eingriff wurde gut vertragen, und es wurden keine neuen Probleme bei den behandelten Tieren festgestellt.
Wie erhofft, sanken die Huntingtin-Proteinspiegel in den behandelten Regionen signifikant. An jeder Injektionsstelle wurden die Proteinspiegel über eine Fläche von etwa sechs Millimetern Durchmesser reduziert – vom Volumen her entspricht das etwa drei M&M’s pro Gehirn. Das mag nicht viel klingen, aber in einem menschlichen Gehirn könnte das einen großen Unterschied machen, und denk daran, diese Messungen wurden 6 Monate nach der einmaligen Behandlung vorgenommen.
Glücklicherweise verursachte das Medikament keine schädlichen Hirnveränderungen wie Entzündungen, Infektionen oder Neuronenschäden.
Das Medikament erfüllte also seine Aufgabe, die Proteinspiegel zu reduzieren, und die Behandlung schien keine schädlichen Wirkungen hervorzurufen. Die Autoren schätzen, dass sechs Affenmonate etwa 18 Menschenmonate entsprechen. Klingt gut – aber wie die Autoren betonen, könnte es beim Menschen noch länger dauern, bis gute oder schlechte Wirkungen auftreten.
Eine innovative Verabreichungsmethode
Der andere neue Artikel entstand aus einer Dreier-Kooperation zwischen dem Team der University of Kentucky, Medtronic und dem RNAi-Medikamentenunternehmen Alnylam Pharmaceuticals. Er wurde im Journal Experimental Neurology veröffentlicht.
Dies war ebenfalls eine Studie über nicht-spezifisches Knockdown-RNAi, das in das Striatum von Affen verabreicht wurde.
Was diese Arbeit auszeichnet, ist die innovative Verabreichungsmethode. Eine Technik namens Convection Enhanced Delivery (CED) wurde verwendet. Dabei werden Schläuche durch den Schädel und in die Hirnsubstanz eingeführt. Das obere Ende des Schlauchs ist mit einer kleinen Pumpe verbunden, die das Medikament unter Druck ständig durch den Schlauch spritzt. Dieser Druck ist entscheidend – er bewirkt, dass sich das Medikamentenmolekül viel weiter ausbreitet, als es sonst der Fall wäre.

CED wird bereits eingesetzt, um Chemotherapeutika in Hirntumoren weiter zu verbreiten. Aber würde es funktionieren, ein RNAi-Medikament zu verabreichen?
Zuerst wurde das Medikament sieben Tage lang in das Gehirn gepumpt. Nur eine Seite des Gehirns wurde behandelt, damit die andere zum Vergleich herangezogen werden konnte. Es wurde eine Reihe von Dosen und Infusionsraten verwendet, um die beste Kombination zu finden. Dann wurde eine 28-tägige Infusion ausprobiert. Clevererweise nahm das Team harmlose radioaktive Modifikationen am Medikament vor, die es ihnen ermöglichten, genau zu messen, wie weit es sich ausgebreitet hatte.
Das Medikament erfüllte seine Aufgabe, die Huntingtin-Spiegel zu reduzieren, und die Schläuche und Infusionen schädigten das Gehirn nicht besonders.
Aber lohnte sich der zusätzliche Aufwand, Schläuche und Pumpen anzubringen – verbreitete sich das Medikament weiter? Kurz gesagt, ja.
Messungen zeigten, dass das RNAi-Medikament viel weiter reichte, als man es mit einfachen Injektionen erwarten würde. Wären beide Seiten des Gehirns behandelt worden, wären die Huntingtin-Spiegel im Volumen von etwa elf M&Ms Gehirn reduziert worden.
Kurz gesagt…
Bevor diese beiden Artikel veröffentlicht wurden, wussten wir bereits, dass Huntingtin im Affengehirn mittels RNAi gesenkt werden kann. Nun können wir zwei wichtige Punkte auf unserer Wunschliste abhaken: erstens, Silencing funktioniert und ist über längere Zeiträume sicher, und zweitens, es gibt Wege, das Medikament weiter zu verbreiten.
Was könnte schiefgehen?
Vorsichtiger Optimismus ist hier ein kluger Ansatz. Es gibt sicherlich einige Dinge, die auf dem Weg zu Humanstudien oder während dieser schiefgehen könnten.
Diese Primatenstudien haben gezeigt, dass die Senkung der Huntingtin-Spiegel bei gesunden Affen sicher ist. Das bedeutet aber nicht, dass es bei menschlichen Patienten definitiv sicher ist. Menschliche Gehirne sind viel größer und komplexer als Affengehirne. Die Behandlung könnte also weniger wirksam oder gefährlicher sein, einfach aufgrund des Artenunterschieds.
Es ist auch möglich, dass das gesunde Protein das Gehirn beim Menschen irgendwie vor seinem schädlichen Bruder schützt. Wenn das der Fall ist, könnte das Silencing beider Kopien unerwartet mehr Schaden als Nutzen anrichten.
Die Gehirne von Menschen mit HD-Symptomen sind wahrscheinlich auch fragiler und schwieriger zu operieren. Die zu behandelnden Hirnbereiche sind aufgrund der durch HD verursachten Schrumpfung kleiner als normal. Die Operationen könnten also schwieriger und riskanter sein.
Schließlich könnte es schwierig sein, den Erfolg beim Menschen zu erkennen, da die Krankheit langsam fortschreitet und wir Patientenhirne nicht unter dem Mikroskop untersuchen können.
Aber vergiss nie – all diese Probleme werden gemeinsam von einigen der besten wissenschaftlichen Köpfe der Welt bearbeitet, die alle darauf abzielen, wirksame Behandlungen für Patienten Realität werden zu lassen.
2012 – das Jahr des Gen-Silencing für HD?
Könnte 2012 das Jahr des Gen-Silencing für HD-Patienten werden? Werden wir in den kommenden Monaten eine oder mehrere Humanstudien sehen? Angesichts der bisherigen Fortschritte glauben wir tatsächlich, dass dies eine vernünftige Hoffnung ist, und mehrere Gruppen arbeiten hart daran, dies Realität werden zu lassen. Die ersten Studien werden klein sein und langsam und mit großer Vorsicht durchgeführt werden, da Sicherheit das oberste Anliegen ist. Aber wenn allles gut geht, werden größere Studien folgen.
Mehr erfahren
- Artikel in Brain über eine 6-monatige RNAi-Behandlung von Grondin und Kollegen (Open Access)
- Artikel in Experimental Neurology über die konvektionsverstärkte Verabreichung von RNAi von Stiles und Kollegen (vollständiger Artikel erfordert Bezahlung oder Abonnement)
- Unser Artikel über die vorherige Sicherheitsstudie an Primaten von Dr. Beverly Davidson
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


