Fokussierung auf Fibrillen; Wissenschaftler geben uns einen Einblick in Huntington-Protein-Klumpen
Wissenschaftler haben leistungsstarke Mikroskope verwendet, um klebrige Fragmente des Huntington-Krankheitsproteins zu betrachten und Licht auf diese Strukturen zu werfen, von denen angenommen wird, dass sie die Krankheit antreiben

Eine Gruppe von Wissenschaftlern der EPFL in Lausanne, Schweiz, hat eine Arbeit im Journal of the American Chemical Society veröffentlicht, in der Klumpen beschrieben werden, die aus einem Fragment des Huntingtin-Proteins bestehen. Ein Wort, das häufig zur Beschreibung dieser verwendet wird, ist „Aggregate“. Mithilfe sehr leistungsstarker Mikroskope konnte das Team hineinzoomen und sich die Details der 3D-Strukturen dieser Proben genauer ansehen. Es wird angenommen, dass die Ansammlung von Huntingtin-Proteinaggregaten ein wichtiges Merkmal der Huntington-Krankheit (HD) ist und zum Fortschreiten der Krankheit beiträgt. Aber bis vor kurzem wussten wir sehr wenig darüber, wie sie aussahen. Mit diesen aufregenden neuen Einblicken in Aggregate unter dem Mikroskop hoffen Wissenschaftler, Werkzeuge zu entwickeln, um sie im Gehirn von Menschen mit HD sichtbar zu machen oder sogar schädliche Aggregate in den Mülleimer in Gehirnzellen zu befördern.
Aggregate, Amyloide und Fasern – was bedeutet das alles?
Viele Krankheiten, die das Gehirn betreffen, darunter neurodegenerative Erkrankungen wie Parkinson, Alzheimer und Huntington, sind durch die Ansammlung von Klumpen von Proteinmolekülen in Gehirnzellen gekennzeichnet. Bei HD ist es ein kleines und klebriges Fragment des Huntingtin-Proteins selbst, das diese Klumpen bildet, die Wissenschaftler oft als Huntingtin-Aggregate bezeichnen.

„Aggregat“ ist ein schickes Wort dafür, wenn viele Kopien desselben Proteinmoleküls zusammenkleben, um viel größere dreidimensionale Strukturen zu bilden. Manchmal sind diese Aggregate ein durcheinander geratenes Durcheinander aus vielen Proteinmolekülen, alles durcheinander. Aber andere Male sind die Moleküle viel besser organisiert und bilden sich wiederholende Strukturen. Einige dieser besser organisierten Strukturen sehen aus wie Fasern und werden als Amyloide oder Fibrillen bezeichnet.
Sie können sich diese verschiedenen Organisationen von Proteinmolekülen wie einen Turm aus Jenga-Steinen vorstellen. Jeder Stein stellt ein einzelnes Proteinmolekül dar. Wenn die Steine alle ordentlich zu einem Turm gestapelt sind, sieht dies ein bisschen aus wie Proteinamyloide oder -fibrillen. Aber wenn die Steine schließlich in einen unordentlichen Haufen fallen, ähnelt dies eher dem, wie wir uns ein unorganisiertes Proteinaggregat vorstellen.
Wissenschaftler sind im Allgemeinen (und ärgerlicherweise) Liebhaber von Fachjargon, daher werden Sie feststellen, dass sie oft alle diese Wörter austauschbar verwenden. Aber für die Zwecke dieses Artikels werden wir uns auf Huntingtin-Fibrillen konzentrieren; organisierte dreidimensionale Fasern, die aus vielen, vielen Kopien eines kleinen und klebrigen Fragments des Huntingtin-Proteins bestehen.
Von Mäusen und Menschen … und Bakterien
Die Aggregation des Huntingtin-Proteins ist ein lange dokumentiertes Merkmal der Huntington-Krankheit. In Gehirnen von Menschen, die an HD verstorben sind, können wir Farbstoffe und andere raffinierte chemische Marker verwenden, um diese Aggregate unter dem Mikroskop in verschiedenen Arten von Nervenzellen zu sehen. In Tiermodellen von HD, die gentechnisch verändert wurden, um das kleine klebrige Fragment des Huntingtin-Proteins herzustellen, haben Wissenschaftler gezeigt, dass sich diese Aggregate im Laufe der Zeit ansammeln. In vielen HD-Modelltieren ist der Anteil der Aggregate in verschiedenen Teilen des Gehirns mit dem Schweregrad der HD-ähnlichen Symptome verbunden.
„Bakterien werden von den Wissenschaftlern so manipuliert, dass sie Huntingtin-Protein-Fabriken sind, die viele, viele Kopien dieses Moleküls herstellen“
Eines der Probleme beim Betrachten der Aggregate im Gehirn ist, dass es viele andere Moleküle in den Zellen gibt, in denen wir Aggregate finden, daher müssen wir im Allgemeinen spezielle Färbungen verwenden, die an den Aggregaten haften, um sie zu sehen. Dieser Ansatz gibt uns jedoch keinen sehr detaillierten Einblick in die Arten der vorhandenen Aggregate oder ihre 3D-Strukturen.
Um dieses Problem zu überwinden, betrachten Wissenschaftler hochreine Proben von Aggregaten, die sie synthetisch im Labor herstellen. Harmlose Bakterien werden von den Wissenschaftlern so manipuliert, dass sie Huntingtin-Protein-Fabriken sind, die viele, viele Kopien dieses Moleküls herstellen. Die Wissenschaftler können dann Huntingtin aus den Bakterien fischen und diese Proben verwenden, um Fibrillen in einem Reagenzglas herzustellen, die denen ähneln, die wir bei Menschen sehen. Die Fibrillen können mit unexpandiertem Huntingtin-Protein oder expandiertem Huntingtin hergestellt werden, was dem Huntingtin-Protein mit und ohne die HD-Mutation entspricht. Dies bedeutet, dass Wissenschaftler die Auswirkungen der HD-Mutation auf die Fibrillen untersuchen können.
Was können mächtige Mikroskope über diese Aggregate enthüllen?
Nachdem das Forscherteam aus der Schweiz diese synthetischen Huntingtin-Fibrillenproben hergestellt hatte, untersuchte es sie mit einem ausgeklügelten Gerät namens Kryo-Elektronenmikroskop. Mit dieser Art von Mikroskop können Sie wirklich hineinzoomen und die Fibrillen sehr detailliert sehen. Die Fibrillen sind extrem klein – nur 3-10 Nanometer breit, etwa 100.000-mal kleiner als die Dicke Ihrer Fingernägel – aber unter dieser Art von Mikroskop leicht sichtbar.
In dieser Studie machten die Wissenschaftler viele Bilder der Fibrillen mit dem Mikroskop und verwendeten dann spezielle Software, um ähnlich aussehende Bilder zu mitteln. Dieser Mittelungsprozess verbessert die Qualität des Bildes, was die Merkmale der Fibrillen leichter erkennbar macht – ein bisschen so, als ob Sie den Kontrast oder die Helligkeit auf Ihrem Telefonbildschirm ändern, um die Anzeige deutlicher zu sehen.
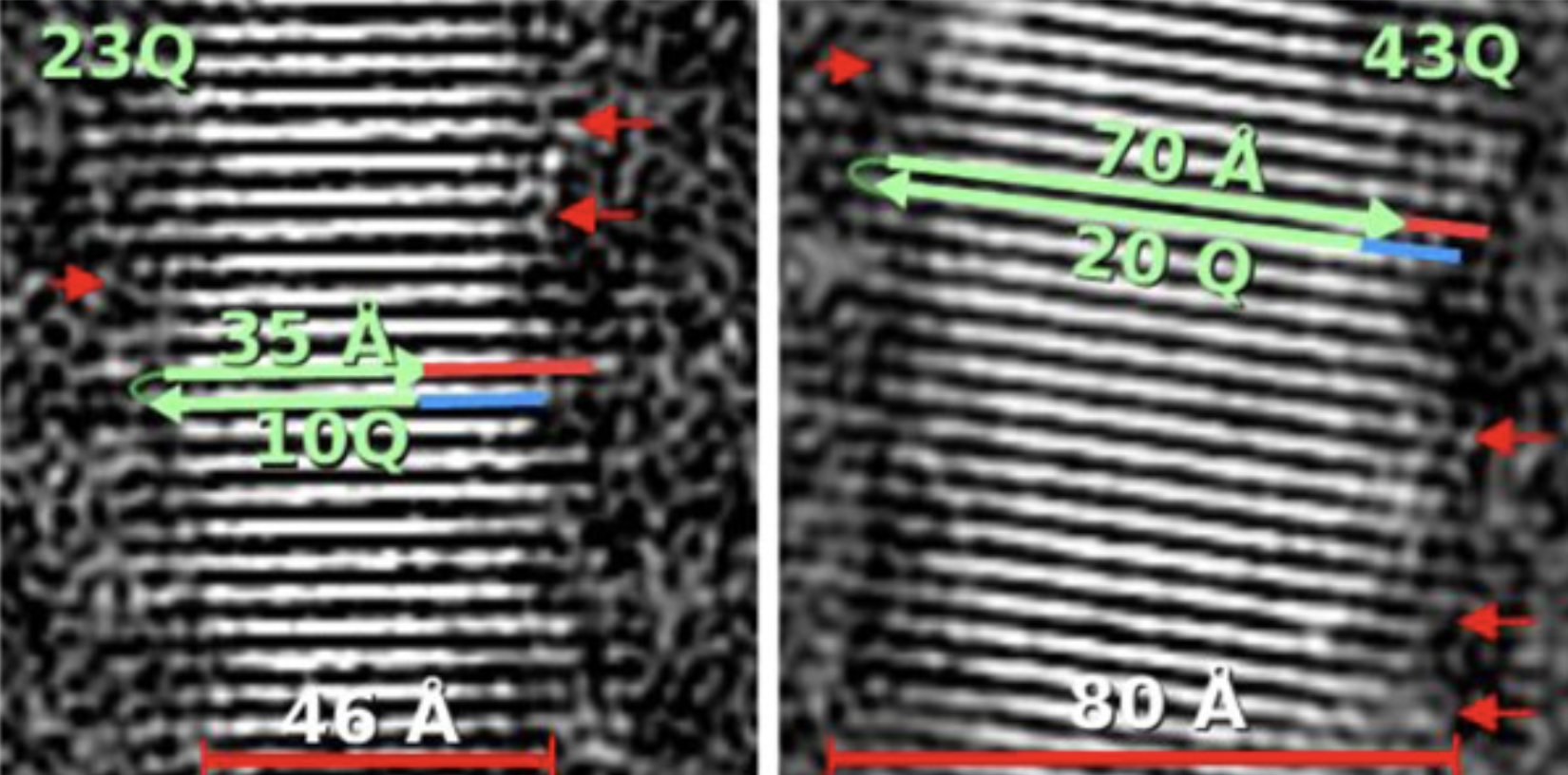
Aus diesen Bildern der Fibrillen konnten die Wissenschaftler ihre Abmessungen messen und herausfinden, wie alle Huntingtin-Proteinmoleküle organisiert waren. Sie konnten sehen, dass sie zusammengestapelt und zu flachen Bändern ausgerichtet waren, was ein bisschen so aussah, als ob man viele Jenga-Steine nehmen und sie alle nebeneinander aufreihen würde, um eine dünne, einzelne Schicht von Steinen zu bilden. Viele Bänder von Huntingtin sind in den Fibrillen übereinander geschichtet, was so wäre, als ob man immer mehr Schichten von aufgereihten Jenga-Steinen auf die erste legen würde.
Interessanterweise fanden die Forscher heraus, dass die HD-Mutation zu Veränderungen in den Abmessungen der Huntingtin-Protein-Fibrillen sowie zu Veränderungen in der Anzahl der übereinander gestapelten Huntingtin-Bänder führte. Die Wissenschaftler stellten auch Fibrillen aus einem noch kleineren Fragment des Huntingtin-Proteins her, dem eine Region ganz am Anfang des Moleküls fehlt. Sie zeigten, dass diese Fibrillen viel unorganisierter waren und aus einer Mischung verschiedener Organisationen der Huntingtin-Proteinmoleküle bestanden.
Diese Ergebnisse sind wichtig, weil sie zeigen, dass die Huntington-Krankheitsmutation und andere Regionen des Huntingtin-Gens die 3D-Struktur und Organisation von Huntingtin-Protein-Fibrillen beeinflussen. Fibrillen, die einheitlich oder unorganisierter sind, könnten die Funktionsweise auf unterschiedliche Weise beeinträchtigen, daher ist es wichtig, dies zu verstehen.
Wie wird diese Arbeit Menschen helfen, die von der Huntington-Krankheit betroffen sind?
Unser tiefes Verständnis der Struktur von Aggregaten im Gehirn der Huntington-Krankheit steckt noch etwas in den Kinderschuhen, aber wir können uns die Arbeit in anderen Krankheitsbereichen ansehen, um zu sehen, welches Versprechen diese Art von Studie bergen kann (abgesehen davon, wirklich coole Bilder der Fibrillen zu erstellen).
„Die Huntington-Krankheitsmutation beeinflusst die 3D-Struktur und Organisation von Huntingtin-Protein-Fibrillen“
Auf dem Gebiet der Alzheimer-Krankheitsforschung wird diese Art von Ansatz nun verwendet, um Fibrillen aus den Gehirnen von Patienten zu untersuchen, die verstorben sind. Diese Arbeit hat ein erstaunliches Detailniveau der Fibrillenstrukturen enthüllt und genau gezeigt, wo sich jedes Atom befindet. Durch den Vergleich von Fibrillen von Menschen mit verschiedenen Formen der Alzheimer-Krankheit konnten Wissenschaftler subtile Unterschiede in ihrer Organisation feststellen und zeigten, dass
Andere Studien zeigen, wie bildgebende Moleküle des Gehirns, sogenannte PET-Liganden, an die Fibrillen binden. Das Huntington-Feld hat einen PET-Liganden, der an Fibrillen bindet (wir haben kürzlich auf HDBuzz darüber geschrieben), aber wir wissen noch nicht genau, wo er an diesen Strukturen bindet, also werden Wissenschaftler vielleicht eines Tages in der Lage sein, diesen Ansatz zu nutzen, um den PET-Liganden besser zu verstehen.
Insgesamt ist die Arbeit der Forscher an der EPFL ein aufregender Schritt nach vorn, da wir beginnen, mehr über Huntingtin-Fibrillen zu verstehen, und hat eine Grundlage für zukünftige Studien gelegt, in denen wir möglicherweise mehr Informationen über dieses wichtige Merkmal von HD gewinnen können.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…