
Screening des gesamten Genoms nach neuen Zielstrukturen für Medikamente gegen HD
Wissenschaftler screenen das GESAMTE Genom, um neue potenzielle therapeutische Zielstrukturen für HD zu finden. Diese ehrgeizige Studie liefert eine Fülle von Daten für HD-Forscher

Eine kürzlich im Fachjournal ‚Neuron‘ veröffentlichte Studie hat neue potenzielle therapeutische Zielstrukturen für die Behandlung der Huntington-Krankheit (HD) identifiziert. Die von Professorin Myriam Heiman und ihren Kollegen durchgeführte Arbeit nutzte modernste genetische Technologien und entdeckte mehrere Gene, die das Fortschreiten von HD in ihren Modellen im Labor verändern könnten. Viele dieser Gene wurden bisher nicht mit HD in Verbindung gebracht und könnten spannende neue Ziele für Forscher sein, die Medikamente und Behandlungen für die HD-Patienten-Community entwickeln.
Ehrgeiziges Screening des gesamten Genoms
Die Zellen in unserem Körper enthalten DNA, die Tausende von Genen kodiert, von denen jedes ein Rezept ist, das unseren Zellen Anweisungen gibt, wie sie ein anderes Proteinmolekül herstellen können. Diese Rezepte werden von unserer DNA in eine Botschaft transkribiert, die als Boten-RNA bezeichnet wird. Die RNA wird dann von zellulären Maschinen in Proteinmoleküle übersetzt. Wissenschaftler können diese Prozesse im Labor manipulieren, um die Rolle verschiedener Gene in unserem Körper zu verstehen.
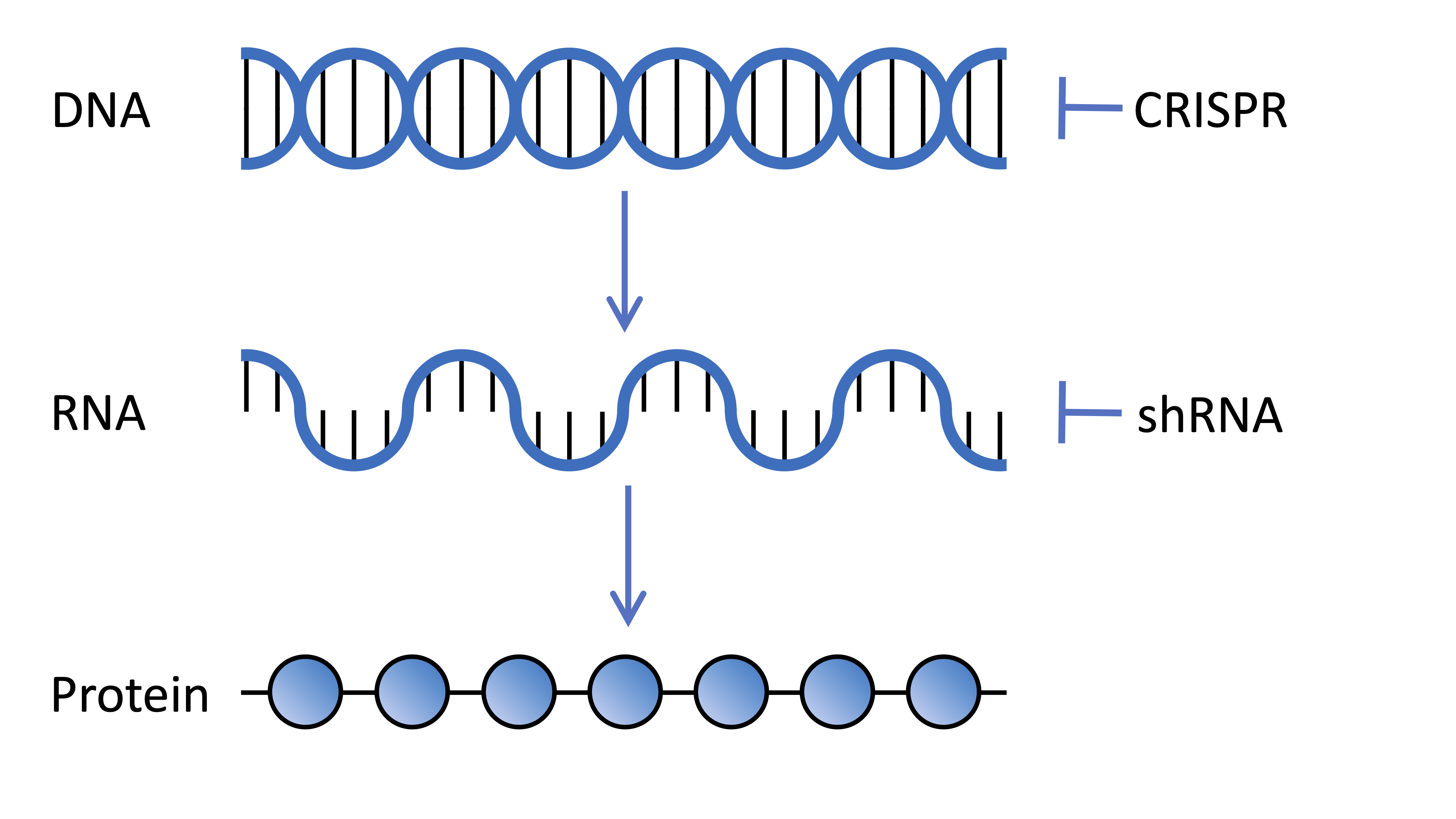
Genetische Screens sollen die Rolle eines einzelnen Gens in verschiedenen Kontexten verstehen. In diesem Fall waren die Forscher daran interessiert, welche Rolle alle verschiedenen Gene in unseren Zellen beim Schutz vor den schädlichen Auswirkungen der HD-Mutation spielen. Die Idee ist also, mit jedem einzelnen Gen zu experimentieren, um herauszufinden, ob dieses Gen Auswirkungen auf die HD-Symptome hat.
Genetische Screen-Technologien können auf viele verschiedene Arten funktionieren, aber sie alle zielen darauf ab, die Expression von Proteinen aus bestimmten Genen zu stoppen oder zu verringern. Gene können direkt angegriffen werden, indem das Genom selbst editiert wird. Andere Technologien greifen in die Boten-RNA ein, die vom Gen transkribiert wird und für die Zellen unerlässlich ist, um das Protein herzustellen, das das Gen kodiert.
Dies mag HDBuzz-Lesern bekannt vorkommen, da es sich um ähnliche Technologien handelt, die bei Huntingtin-senkenden Therapien eingesetzt werden, die derzeit in verschiedenen klinischen Studien untersucht werden. Während diese Huntingtin-senkenden Therapien nur auf das Huntingtin-Gen abzielen, zielen die Forscher im Fall dieses genetischen Screens auf jedes Gen im Genom einzeln ab, um herauszufinden, welche Rolle es bei HD spielt.
Das Broad Institute, in dem Prof. Heiman arbeitet, ist weltweit führend in der Entwicklung von Bibliotheken, die für genetische Screens verwendet werden können. In dieser Studie verwendeten die Forscher zwei verschiedene Technologien in ihrem Screen, die beide durch spezielle Arten von Viren in Gehirnzellen eingebracht werden. Erstens Short-Hairpin-RNAs, die auf die Boten-RNA abzielen und die Expression des Gens herunterregulieren, indem sie die Übersetzung der Botschaft in das funktionelle Proteinmolekül unterbrechen. Zweitens wurde CRISPR verwendet, um die Gensequenz im Genom direkt zu editieren und ihre Fähigkeit zu stören, eingeschaltet zu werden, um das Protein herzustellen, das sie kodiert.
Systematische genetische Screens in verschiedenen Tiermodellen gibt es seit Jahrzehnten für einfachere Systeme wie Würmer und Fliegen. Diese Art von Experimenten war jedoch für das Gehirn von Säugetieren viel schwieriger durchzuführen, was Wissenschaftler behindert hat, die daran interessiert sind, diese Screens durchzuführen, um verschiedene neurodegenerative Erkrankungen zu verstehen.
Das Team von Prof. Heiman konnte diese Schwierigkeiten überwinden, indem es einen Weg fand, die Reagenzien, die in die Gehirne der Mäuse im genetischen Screen injiziert werden müssen, zu bündeln und zu konzentrieren, und konnte direkt auf das Striatum abzielen, das der Bereich des Gehirns ist, an dem sie interessiert waren. Das Striatum ist die am stärksten betroffene Hirnregion bei HD-Patienten, weshalb dieser Bereich ausgewählt wurde.
Über 20.000 Gene wurden in dieser einen Studie untersucht
Anstatt sich in ihren Mausmodellen mit bekannten Genen zu befassen, die mit Neurodegeneration in Verbindung stehen, verfolgten die Wissenschaftler in dieser Studie einen unvoreingenommenen Ansatz und führten ein genomweites Screening durch, um die Rolle zu untersuchen, die fast jedes Gen spielt. Tatsächlich screenen sie fast alle der etwa 22.000 Gene, die in Mäusen gefunden wurden! Dies war ein unglaublich ehrgeiziger Ansatz und liefert eine Fülle von Daten für Forscher auf dem Gebiet der HD und darüber hinaus.
Da dies das erste systematische Screening aller Gene im zentralen Nervensystem von Säugetieren war, verwendeten die Forscher normale Mäuse ohne bekannte Mutationen, um herauszufinden, welche Gene für das Überleben von Gehirnzellen unter normalen Bedingungen wichtig sind. Es wurde gezeigt, dass Gene, die zuvor in systematischen Screens in einfacheren Modellen wie Fliegen und Würmern identifiziert wurden, auch in Mäusen wichtig sind.
In dieser Studie wurden jedoch viele neue Gene identifiziert, darunter mehrere, die eine Rolle im Stoffwechsel in Zellen spielen. Diese wurden zuvor nicht in anderen systematischen Screens in Fliegen oder Würmern identifiziert, was wahrscheinlich daran liegt, dass das zentrale Nervensystem von Säugetieren mehr Energie benötigt und stärker von Genen abhängig ist, die den Zellen helfen, Energie zu produzieren. Diese Ergebnisse sind eine gute Erinnerung daran, wie wichtig es für Wissenschaftler ist, ihre Forschungsergebnisse im Kontext der untersuchten Tiermodelle zu betrachten.

Zusätzlich zum Kontrollmausmodell wurden in diesem Experiment zwei verschiedene HD-Mausmodelle verwendet, R6/2 und zQ175, die beide in der HD-Forschungsliteratur ausführlich beschrieben werden. Durch den Vergleich der Gene, die im Screen in den HD-Mausmodellen identifiziert wurden, mit denen, die in den Kontrollmäusen identifiziert wurden, konnten Wissenschaftler herausfinden, welche Gene speziell für HD wichtig sind, und nicht Gene, die die Gehirnzellfunktion im Allgemeinen beeinflussen.
Für die genetischen Screens, die an den beiden in der Studie verwendeten HD-Mausmodellen durchgeführt wurden, wurden etwa 500 Gene als wichtig für das Fortschreiten von HD identifiziert. Viele dieser Gene spielen eine Rolle in Signalwegen, die Wissenschaftler zuvor in anderen Studien identifiziert haben, wie z. B. den genomweiten Assoziationsstudien (GWAS), die nach Genen suchten, die das Alter des Beginns der HD-Symptome bei menschlichen Patienten verändern können. Dazu gehören Gene, die an DNA-Schadensreparaturwegen beteiligt sind, die die Integrität unseres genetischen Materials erhalten, sowie Gene in Transkriptionswegen, die regulieren, wie die Boten-RNA in Zellen verarbeitet wird und welche Proteinmoleküle hergestellt werden.
Im Screen wurden auch neue Genziele identifiziert, darunter Gene, die zur Nme-Familie gehören. Es wurde zuvor berichtet, dass Nme-Gene mit der Ausbreitung in einigen Krebsarten in Verbindung stehen, aber dies ist das erste Mal, dass sie mit HD in Verbindung gebracht wurden. Heiman und Kollegen glauben, dass die Ausrichtung auf den Nme-Signalweg wichtig sein könnte, um den Gehirnzellen zu helfen, mutiertes Huntingtin-Protein in HD-Gehirnen loszuwerden. Wenn wir Therapeutika entwickeln können, die diesen Signalweg modulieren, könnte dies ein potenzieller Weg sein, um HD zu behandeln.
Neue Ansätze für die Herstellung neuer HD-Medikamente
Auch wenn viele bahnbrechende klinische Studien laufen, in denen verschiedene Therapien für HD-Patienten getestet werden, ist es wichtig, dass Forscher weiterhin nach alternativen Wegen suchen, um potenziell neue Medikamente für HD herzustellen. Diese Forschung liefert eine Fülle von Daten über HD, wie sie in Mausmodellgehirnen funktioniert, und gibt uns auch Ideen für neue Ziele, die wir als potenzielle Angriffspunkte für Medikamente verfolgen können, die eines Tages in der Pipeline der Medikamentenentwicklung landen könnten. Es wird spannend sein zu sehen, wie diese neuen Ansätze von Forschern auf der ganzen Welt weiterverfolgt werden und wie diese Technologie auf andere neurodegenerative Erkrankungen angewendet werden könnte.
Mehr erfahren
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


