
Im direkten Vergleich mit Tau: Neue Erkenntnisse über die chemischen Grundlagen der Huntington-Krankheit
Trägt das Tau-Protein – das bei anderen neurodegenerativen Erkrankungen Probleme verursacht – zur Huntington-Krankheit bei?
Wir wissen, dass die Ursache der Huntington-Krankheit eine genetische Veränderung ist, die zu einem schädlichen Protein führt: mutiertes Huntingtin. Aber andere Proteine können in den Kampf hineingezogen werden und zu den Problemen beitragen, mit denen von HD betroffene Zellen konfrontiert sind. Neue Forschungsergebnisse deuten darauf hin, dass sich ein ziemlich berüchtigtes Protein namens ‚Tau‘ – ein bekannter Unruhestifter bei anderen degenerativen Hirnerkrankungen – ansammelt und Schäden bei HD verursacht.
Eine Rolle für Tau bei HD?
Um wirksame Behandlungen für eine Krankheit zu entwickeln, müssen wir zunächst verstehen, wie sie die normalen Funktionen des Körpers stört. Wir wissen, dass bei der Huntington-Krankheit das Vorhandensein eines mutierten Gens dazu führt, dass Zellen ein schädliches Protein produzieren, das wir mutiertes Huntingtin nennen. Es ist bekannt, dass diese Form von Huntingtin zu Proteinklumpen, sogenannten Einschlüssen oder Aggregaten, verklumpt und die normale Funktion von Neuronen stört.
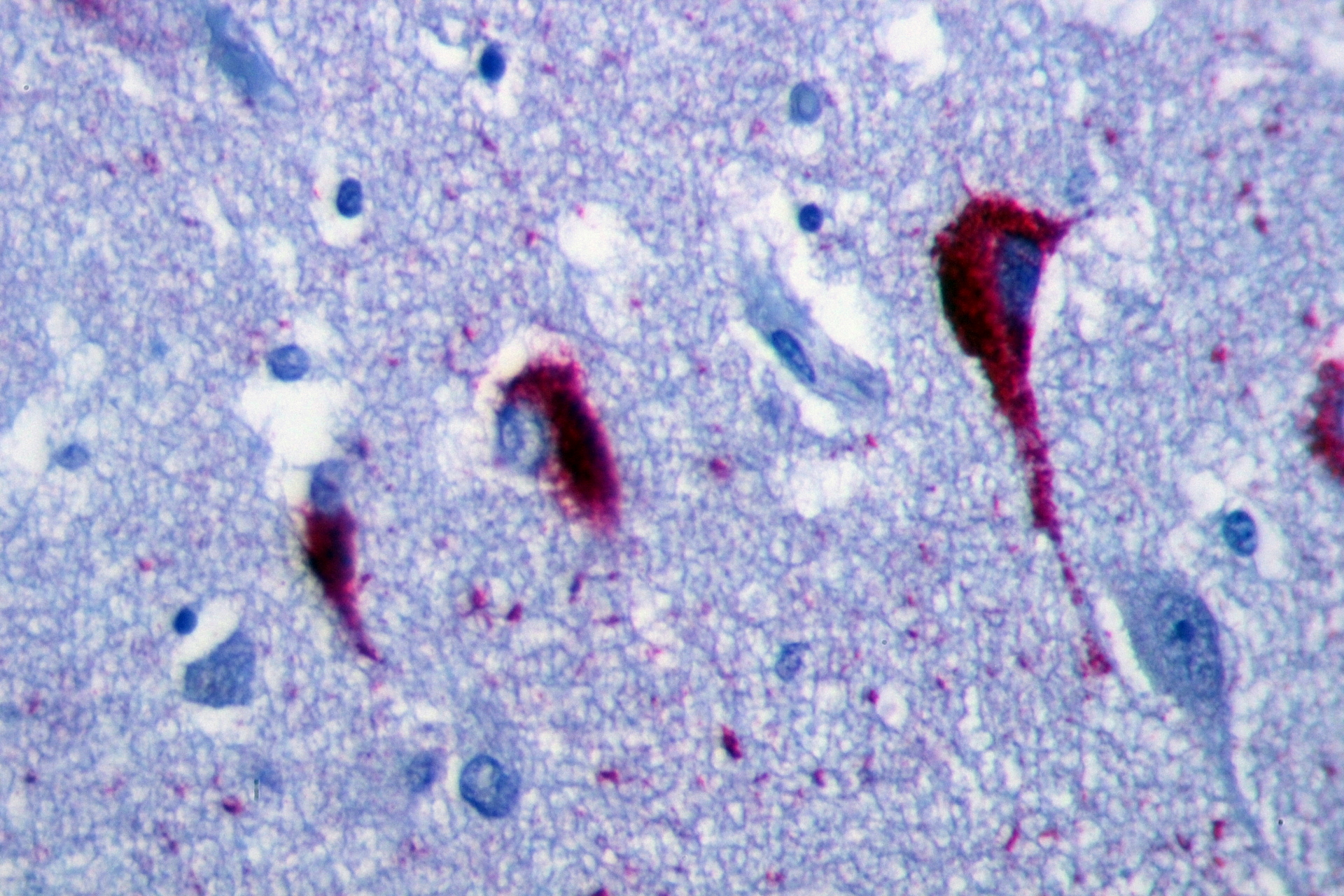
Bildnachweis: Patho [CC-BY-SA-3.0]
Neue Forschungsergebnisse einer Gruppe in Spanien unter der Leitung von Dr. Jose Lucas haben nun eine Verbindung zwischen dem mutierten Huntingtin-Gen und einem anderen berüchtigten Protein namens Tau aufgedeckt.
Tau kommt in Neuronen vor, wo es mit winzigen Strukturen, den sogenannten Mikrotubuli, verbunden ist. Diese Mikrotubuli fungieren als ‚Stützbalken‘ und erhalten die Struktur der Zelle aufrecht, ähnlich wie Metallrahmen Gebäude stützen.
Bei der sorgfältigen Untersuchung der Gehirne von HD-Patienten, die für die Forschung gespendet wurden, stellte das Team von Lucas fest, dass Tau in stabförmigen Strukturen im Kontrollzentrum oder ‚Kern‘ von Neuronen verklumpt vorliegt, anstatt in den Mikrotubuli, wo es sich normalerweise aufhält. Sie maßen auch die Gesamtmenge an Tau in HD-Gehirnen und stellten fest, dass sie unerwartet hoch war.
Es gibt mehrere ähnliche Formen von Tau. Die bekanntesten sind ‚3-Repeat‘- und ‚4-Repeat‘-Tau, benannt nach der Anzahl, wie oft ein bestimmter Bestandteil im endgültigen Protein enthalten ist. Dieser Bestandteil ist wichtig – er ermöglicht es Tau, an Mikrotubuli zu haften. Man kann sich diese Formen von Tau so vorstellen, dass sie 3 oder 4 ‚Hände‘ haben, um die Mikrotubuli zu greifen.
Das Team von Lucas fand nicht nur mehr Tau-Protein als erwartet in HD-Gehirnen, sondern auch, dass das übliche Gleichgewicht von 3- und 4-Repeat-Tau verändert war – es gab mehr 4-Repeat-Tau als erwartet.
Schneiden, würfeln und spleißen
HD-Gehirne haben also zu viel Tau, und zu viel von diesem Tau ist die 4-Repeat-Variante, und es verklumpt zu seltsamen Stäben. Was verursacht all diese Tau-Anomalien bei HD?
Schauen wir uns zunächst an, wie Zellen verschiedene Versionen desselben Proteins herstellen.
„Dies ermöglicht es uns, ‚auf den Schultern von Riesen zu stehen‘ – wir können uns das zunutze machen, was Alzheimer- und FTD-Forscher bereits über Tau gelernt haben, wie es Probleme verursacht und wie man es bekämpft.“
Unsere Gene sind wie ein Rezeptbuch, geschrieben in der chemischen Sprache der DNA, das den Zellen sagt, wie sie all die verschiedenen Proteine bauen sollen, die sie benötigen. Da diese Rezepte für die normale Funktion der Zellen so wichtig sind, werden sie im Zellkern aufbewahrt. Um also ein Protein herzustellen, erstellt die Zelle zunächst eine ‚Arbeitskopie‘ des Rezepts, die aus einem DNA-ähnlichen Molekül namens mRNA besteht.
So wie einige Rezepte optionale Zusätze oder Variationen enthalten, enthalten viele Gene ‚optionale‘ Informationen, die für die Proteinproduktion nicht unbedingt erforderlich sind.
Unsere Zellen sortieren also zuerst die mRNA, um Anweisungen zu entfernen, die für die jeweilige Proteinsorte, die hergestellt wird, nicht benötigt werden.
Diese Verarbeitung von mRNA wird von einer Gruppe von Proteinen, den sogenannten Spleißfaktoren, durchgeführt. Sie schneiden die unerwünschten Teile der mRNA heraus und lassen nur die Teile übrig, die für die Herstellung eines Proteins notwendig sind.
Im Fall von Tau enthält ein einziges genetisches Rezept Anweisungen zur Herstellung von 3-Repeat- und 4-Repeat-Tau. Welche Version tatsächlich hergestellt wird, hängt von einem Spleißfaktor namens
Da sein Team in den Gehirnen von HD-Patienten mehr 4-Repeat-Tau als erwartet gefunden hatte, fragte sich das Team von Lucas, ob SRSF6 bei HD aktiver sein könnte. Und tatsächlich fanden sie erhöhte SRSF6-Werte in HD-Neuronen. Darüber hinaus schien SRSF6 in den Klumpen von mutiertem Huntingtin zu kleben. Es scheint eine Affinität zwischen SRSF6 und etwas in diesen Einschlüssen zu geben. Ein Kandidat ist die mRNA für das mutierte Huntingtin-Protein, an das SRSF6 zuvor nachweislich bindet.
Die Forscher zeigten weiterhin ähnliche Ungleichgewichte von 3-Repeat- und 4-Repeat-Tau in den Gehirnen von Mäusen mit der HD-Mutation. Und als HD-Mäuse genetisch so manipuliert wurden, dass sie weniger Tau produzierten, waren einige ihrer üblichen HD-ähnlichen Bewegungsprobleme weniger schwerwiegend.
Viele Fliegen mit einer Klappe schlagen

Die übergreifende Botschaft dieser Arbeit ist also, dass das mutierte Huntingtin-Gen mutierte Huntingtin-mRNA produziert, an die SRSF6 bindet. Die erhöhten SRSF6-Werte verändern dann das Gleichgewicht der mRNA für ein anderes Protein, Tau – was zu einer Überproduktion der 4-Repeat-Form von Tau führt. Das 4-Repeat-Tau bildet dann seltsame Stabstrukturen, die zu den Problemen von HD-Gehirnen beitragen können.
Warum ist diese Arbeit wichtig? Warum ist es wichtig, dass sich Stäbe aus 4-Repeat-Tau in Neuronen bilden?
Tau hat einen gewissen Ruf. Es wurde mit anderen ‚degenerativen‘ Hirnerkrankungen wie der Alzheimer-Krankheit und der frontotemporalen Demenz (FTD) in Verbindung gebracht, um nur einige zu nennen.
Bei einer Form von FTD reicht das Vorhandensein von zu viel 4-Repeat-Tau im Vergleich zu 3-Repeat-Tau aus, um eine Neurodegeneration zu verursachen. Klingt bekannt! Das ist genau das, was das spanische Team in diesen von HD betroffenen Gehirnen beobachtet hat.
Bei der Alzheimer-Krankheit bildet Tau Strukturen, die als ’neurofibrilläre Knäuel‘ bezeichnet werden, d. h. große Bündel von Tau-Protein, die Neuronen schädigen.
Die Feststellung, dass Tau an HD beteiligt sein könnte, könnte nützlich sein, da sie es uns ermöglicht, ‚auf den Schultern von Riesen zu stehen‘ – wir können uns das zunutze machen, was Alzheimer- und FTD-Forscher bereits über Tau gelernt haben, wie es Probleme verursacht und wie man es bekämpft.
Bedeutet dies, dass die Huntington-Krankheit eigentlich ein Tau-Problem oder eine ‚Tauopathie‘ ist, wie Forscher Zustände nennen, bei denen Tau die Schuld trägt? Nicht wirklich – wir wissen mit Sicherheit, dass HD durch ein mutiertes Huntingtin-Gen verursacht wird. Obwohl es also scheint, dass Tau an HD beteiligt sein könnte, ist es sicherlich nicht für alle Probleme verantwortlich, die die Mutation verursacht.
Diese neue Krankheitsverbindung gibt uns eine faszinierende neue Denkweise über die Huntington-Krankheit und wie man sie behandeln kann – und dank der vernetzten Natur der Wissenschaft haben wir bereits einige Einblicke in das, was passiert, wenn Tau in den Kampf hineingezogen wird.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


