Verursacht ein „rostiges Scharnier“ die Huntington-Krankheit?
Kanadische Wissenschaftler haben herausgefunden, dass das mutierte Huntingtin-Protein weniger flexibel ist als normal.

Herauszufinden, wie das mutierte Huntingtin-Protein Schäden verursacht, ist das zentrale Problem der Huntington-Forschung. Nun hat ein Team kanadischer Forscher unter der Leitung von Dr. Ray Truant gezeigt, dass das Protein eine wichtige ‚Scharnier‘-Funktion hat, die in Zellen mit der HD-Mutation weniger gut funktioniert. Aufregend, aber entgegen dem, was Sie vielleicht gelesen haben, bedeutet das nicht, dass wir keine Mäuse mehr untersuchen müssen!
Huntingtin
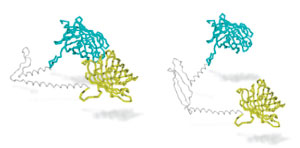
Bildnachweis: Caron et al, PNAS 2013
Ein großer Vorteil für Forscher, die die Huntington-Krankheit untersuchen, ist, dass wir, anders als bei vielen anderen Hirnerkrankungen, genau wissen, was sie verursacht. Eine Mutation in einem einzigen Gen weist Zellen an, ein schädliches Protein herzustellen: mutiertes Huntingtin. Es ist das mutierte Huntingtin, das Neuronen und andere Zellen schädigt und die Symptome von HD verursacht.
In den 20 Jahren seit seiner Entdeckung haben wir viel darüber herausgefunden, was das Huntingtin-Protein normalerweise tut und was schief geht, wenn sein toxischer Zwilling, mutiertes Huntingtin, hergestellt wird.
Die Untersuchung von Huntingtin ist entscheidend für unsere Bemühungen, Behandlungen für HD zu entwickeln, denn herauszufinden, wie und warum mutiertes Huntingtin Schaden verursacht, ist ein wichtiger Schritt, um diesen Schaden zu verhindern.
Zu viele Glutamine
Proteine werden aus langen Ketten von Bausteinen, sogenannten Aminosäuren, hergestellt. Diese sind wie eine Perlenkette miteinander verbunden, und die genaue Reihenfolge der Aminosäuren bestimmt die Form und das Verhalten des Proteins.
Eine kleine Veränderung in der Reihenfolge der Aminosäuren kann eine große Veränderung in der Form eines Proteins verursachen, und das kann dramatisch verändern, wie es seine Aufgabe in den Zellen erfüllt oder es sogar giftig machen.
Mutiertes Huntingtin unterscheidet sich vom ’normalen‘ Protein nur in einer Hinsicht: Nahe dem Anfang der Kette hat das Huntingtin-Protein eine Sequenz, in der sich ein Baustein, Glutamin, mehrmals wiederholt. Die übliche Anzahl von Glutaminen liegt zwischen zehn und zwanzig.
Die Huntington-Krankheit tritt auf, wenn es zu viele Glutamine gibt.
Was ist die magische Zahl?
Wie viele Glutamine braucht es also, bevor das Huntingtin-Protein anfängt, Schaden zu verursachen? Seltsamerweise ist die Antwort siebenunddreißig. Darunter verursacht das Protein Huntingtin unseres Wissens keine Huntington-Krankheit. Darüber ist HD unvermeidlich, solange eine Person lange genug lebt.
Warum in aller Welt sollte sich die Situation bei 37 Glutaminen ändern? Wir wissen es nicht! Aber die Aufklärung dieses Rätsels hat für HD-Forscher höchste Priorität.
Noch seltsamer ist, dass die meisten Menschen mit Huntington-Krankheit zwischen 40 und 60 Glutamine haben, aber diese Anzahl zusätzlicher Glutamine keine Krankheit bei anderen Tieren wie Mäusen verursacht. Tiermodelle der HD müssen weit über hundert Glutamine in ihrem Huntingtin-Protein haben, bevor wir anfangen, Symptome zu sehen.
Dies ist ein weiteres Rätsel, und eines, das darauf hindeutet, dass Huntingtin subtile, aber sehr wichtige chemische Probleme beim Menschen verursacht, die unsere Tiermodelle nicht erkennen können.
Was ist mit CAG?
„Menschliche Zellen könnten verwendet werden, um Medikamente zu identifizieren, die dem Scharnier helfen, zu funktionieren, aber sie müssen trotzdem an Tieren, einschließlich Mäusen, getestet werden“
Woher kommen diese zusätzlichen Glutamine, werden Sie sich vielleicht fragen. Die Antwort liegt im HD-Gen, das ein Rezept oder eine Reihe von Anweisungen zur Herstellung des Huntingtin-Proteins ist. So wie das Protein viele Glutamine in der Nähe des Anfangs hat, hat das Gen eine Strecke, in der sich die chemischen ‚Buchstaben‘ C-A-G wiederholen. Die Anzahl der ‚CAG‘-Wiederholungen im Gen entspricht der Anzahl der Glutamin-Bausteine im Protein. Und wenn es zu viele CAGs im Gen gibt, wird es zu viele Glutamine im Huntingtin-Protein geben.
Was gibt es Neues?
Professor Ray Truant, sein Student Nick Caron und Truants Team an der McMaster University in Kanada haben gerade einen Artikel in der Fachzeitschrift PNAS veröffentlicht, in dem sie ihre Arbeit zur Untersuchung der Auswirkungen der Anzahl der Glutamine auf das Huntingtin-Protein beschreiben. Zum ersten Mal haben sie eine potenziell wichtige Veränderung gefunden, die um die kritische Zahl von 37 Glutaminen herum stattfindet.
Die Proteinabschnitte auf beiden Seiten all dieser Glutamine werden als ‚Upstream‘– und ‚Downstream‘-Regionen bezeichnet. Frühere Forschungen haben gezeigt, dass jede von ihnen eine Rolle dabei spielt, dem mutierten Protein seine schädlichen Eigenschaften zu verleihen.
Truants Team untersuchte, ob die Upstream- und Downstream-Regionen tatsächlich zusammenarbeiten könnten, wobei das Glutamin-Stück dazwischen wie ein Scharnier wirkt. Sie fragten sich auch, ob dieses ‚Scharnier‘ im mutierten Protein möglicherweise nicht richtig funktioniert.
Zeit für eine Herr der Ringe-Analogie
Um dies zu untersuchen, brauchten sie eine Möglichkeit, herauszufinden, ob die Upstream- und Downstream-Regionen nahe genug beieinander liegen, um zusammenzuarbeiten. Sie verwendeten eine clevere Art von ‚Näherungssensor‘, der als FLIM-FRET bezeichnet wird.
Erinnern Sie sich an Frodos Schwert ‚Stich‘ in den Herr der Ringe-Filmen und daran, wie es blau leuchtet, wenn Orks in der Nähe sind? FLIM-FRET ist so ähnlich.
Die Forscher befestigten spezielle lichtempfindliche Anhängsel am Huntingtin-Protein, eines an der Upstream-Region und eines an den Downstream-Regionen. Diese tun nichts, es sei denn, das Protein faltet sich und bringt die beiden Regionen zusammen. Wenn das passiert, wird Licht von einem Tag zum anderen weitergeleitet, leuchtet heraus (wie Frodos Schwert) und kann gemessen werden.
Das rostige Scharnier von HD
Truants Stich-ähnlicher Näherungssensor bewies, dass die Upstream- und Downstream-Regionen in Zellen tatsächlich wieder zusammengefaltet werden, wobei der Glutamin-Abschnitt wie ein Scharnier wirkt. Außerdem leuchtete er weniger hell, wenn sich 37 oder mehr Glutamine im Huntingtin befanden, was darauf hindeutet, dass Probleme mit dem Scharnier um diese Zahl herum beginnen. Truant nennt dies die ‚Rostige-Scharnier-Hypothese‘ und schlägt vor, dass dies eine Möglichkeit ist, wie das mutierte Protein Schaden verursachen könnte.
Truants Team bestätigte diese Ergebnisse mit Proteinen unterschiedlicher Länge und zeigte letztendlich die gleiche Anomalie in Hautzellen, die direkt von einem Huntington-Patienten entnommen wurden.
Verknüpfung
Wie passt diese ‚Rostiges Scharnier‘-Idee zu anderen Dingen, die wir bereits über mutiertes Huntingtin wissen?

Nun, wir wissen, dass ein anderes Protein namens PACSIN an die Downstream-Region von Huntingtin binden kann. Hier zeigte Truants Team, dass es auch an die Upstream-Region binden kann, was darauf hindeutet, dass es die beiden Regionen über das Glutamin-Scharnier hinweg zusammenhalten kann – wie ein Türschließmechanismus.
Als PACSIN künstlich entfernt wurde, leuchtete der Näherungssensor weniger, was darauf hindeutet, dass die Upstream- und Downstream-Regionen auseinandergesprungen waren. Das Verhalten von PACSIN zu verändern, könnte das Scharnierproblem beheben – ein möglicher neuer Ansatz, um über die Behandlung der Huntington-Krankheit nachzudenken.
Die andere Verbindung zu unserem bestehenden Verständnis kommt von winzigen chemischen Veränderungen, die Zellen an Proteinen vornehmen. Diese chemischen ‚Tags‘ können verändern, wie sich Proteine verhalten und wo sie landen. Truants Team hatte zuvor gezeigt, dass ‚Phospho‘-Tags wichtig sind, um zu bestimmen, wohin das Huntingtin-Protein geht und wie schädlich es ist.
In ihrer neuesten Arbeit zeigten sie, dass diese Phospho-Tags auch einen Einfluss auf die Aktivität des Glutamin-Scharniers haben können. Dies unterstützt die Idee, dass Medikamente zur Kontrolle der Phospho-Tagging einige schädliche Auswirkungen des mutierten Proteins verhindern könnten.
Was diese Forschung zeigt
Truants Team hat wirklich gute Arbeit geleistet, indem es einen Näherungssensor erfunden (oder sich einen von Frodo Beutlin geliehen) und damit gezeigt hat, dass die entscheidende Glutaminregion von Huntingtin – das Stück, das bei HD zu lang ist – als Scharnier fungiert, das es den Upstream- und Downstream-Regionen ermöglicht, zusammenzuarbeiten.
In der Zwischenzeit überspannt ein anderes Protein, PACSIN, das Scharnier und zieht sie zusammen. Und sie haben die Scharnierfunktion mit dem Phospho-Tagging von Huntingtin in Verbindung gebracht. Darüber hinaus scheint diese Scharniereigenschaft ungefähr mit der gleichen Anzahl von Glutaminen schief zu gehen, die bei menschlichen Patienten Krankheiten verursachen.
Dies sind nicht nur neue Informationen über das Huntingtin-Protein und wie es Schäden verursacht. Es gibt uns auch neue Ideen für mögliche Behandlungen – durch die Veränderung des Verhaltens von PACSIN1 oder der Maschinerie, die das Phospho-Tagging steuert.
Was es nicht zeigt
Dies wäre kein HDBuzz-Artikel ohne einen Warnhinweis. In diesem Fall halten wir es für wichtig, einige der Dinge hervorzuheben, die die Forschung uns nicht sagt – im Gegensatz zu dem, was Sie vielleicht online gelesen haben.
CBC News berichtete, dass die Arbeit „die Notwendigkeit von Mausversuchen umgeht“, da Truants Ergebnisse in menschlichen Zellen gesehen werden konnten. Leider stimmt das nicht. Menschliche Zellen könnten verwendet werden, um schnell Medikamente zu identifizieren, die dem ‚Scharnier‘ helfen, besser zu funktionieren, aber diese Medikamente müssen trotzdem an Tieren, einschließlich Mäusen, getestet werden. Um HD zu besiegen, brauchen wir jede Hilfe, die wir bekommen können. Kein einzelnes Tiermodell ist perfekt für die Entwicklung von Medikamenten – aber auch nicht menschliche Zellen, die in einer Schale wachsen, oder gar menschliche Patienten allein. Verschiedene Modellsysteme tragen jeweils nützliche Informationen bei, die uns helfen, Fortschritte zu machen.
Eine andere Sache, die uns diese Arbeit nicht gibt, ist ein vollständiges Verständnis dafür, wie das Scharnierproblem dazu führt, dass das Huntingtin-Protein schädlich wird. Oft finden wir in der Forschung hinter jeder Tür eine weitere Tür, deren Öffnung mehr Arbeit erfordert. Truants Team und andere werden nun daran arbeiten, das Gesamtbild zu verstehen, wie sich das Scharnierproblem von Huntingtin auf die Funktionsweise der Zelle und des Gehirns auswirkt. Und diese Erkenntnisse in Behandlungen umzuwandeln, die von Patienten eingenommen werden könnten, wird noch mehr Arbeit erfordern. Also machen wir weiter!
Mehr erfahren
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…