Beruhigung des Immunsystems hilft Huntington-Mäusen
CB2-aktivierendes Medikament verbessert das Überleben und die Symptome bei Huntington-Mäusen durch Beruhigung des Immunsystems

Es wird angenommen, dass sich das Immunsystem bei der Huntington-Krankheit abnormal verhält. Jetzt wurde gezeigt, dass ein Medikament, das CB2-Rezeptoren auf Immunzellen aktiviert, die Symptome verbessert und das Überleben von HD-Mäusen verlängert – mit interessanten Auswirkungen auf das Immunsystem als Ziel für HD-Therapien.
Das Immunsystem bei HD
Die Huntington-Krankheit wird als neurodegenerative Erkrankung bezeichnet, da die meisten Symptome durch die Fehlfunktion und den Tod von Neuronen verursacht werden. Aber das mutierte Huntingtin-Protein, das HD verursacht, wird von jeder Zelle im Körper produziert, und in den letzten Jahren haben Forscher bei der Suche nach HD-Behandlungen über das Gehirn hinausgeschaut.
Bildnachweis: Society for Neuroscience (Bouchard et al.)
Eine Entdeckung, die sich aus diesem Ganzkörperansatz ergeben hat, ist, dass sich das Immunsystem – unsere Abwehr gegen Infektionen und Verletzungen – bei HD-Patienten etwas anders zu verhalten scheint.
Im Durchschnitt sind die Spiegel von Immun-Signalchemikalien, den sogenannten Zytokinen, bei Menschen mit der Huntington-Krankheitsmutation höher als normal, noch bevor die Symptome beginnen. Und weiße Blutkörperchen von HD-Patienten sind hyperaktiv – wenn sie im Labor gezüchtet und mit Chemikalien aus Bakterien angefeuert werden, produzieren sie mehr Zytokine als normal.
Die Zusammenhänge zwischen dem HD-Gen, dem Verhalten des Immunsystems und dem Gehirn werden noch erforscht. Aber es gibt bereits Anzeichen dafür, dass die künstliche Veränderung des Immunsystems eine Möglichkeit sein könnte, HD zu bekämpfen.
Letztes Jahr zeigte eine Gruppe von Forschern unter der Leitung von Dr. Paul Muchowski am Gladstone Institute of Neurological Disease in Kalifornien, dass die Veränderung des chemischen Verhaltens von weißen Blutkörperchen mit einem Medikament namens JM6 das Leben von HD-Mäusen verlängerte. Und Anfang dieses Jahres berichtete Muchowskis Team, dass die Transplantation von Knochenmark von ’normalen‘ Mäusen in HD-Mäuse leicht vorteilhaft war.
Die Untersuchung des Immunsystems zum Verständnis von HD und als Ziel für mögliche Behandlungen ist also im Moment ein heißes Thema. Und mit einer neuen Arbeit im Journal of Neuroscience hat Muchowskis Team es wieder getan – diesmal mit einer bemerkenswerten Studie, die sich auf die Aktivität von ‚CB2-Rezeptoren‘ im Immunsystem konzentriert.
CB2-Rezeptoren?
Ein Rezeptor ist ein Molekül, das aus einer Zelle herausragt und darauf wartet, dass eine Signalchemikalie es erreicht. Wenn das passiert, löst der Rezeptor eine Reihe von chemischen Ereignissen innerhalb der Zelle aus, die schließlich das Verhalten der Zelle verändern.
Jeder Rezeptor ist nur in der Lage, eine bestimmte Art von Signalchemikalie zu ‚fangen‘, und jeder Rezeptor verursacht seine eigene Reihe von Ereignissen in der Zelle. So ist jede Zelle in unserem Körper in der Lage, angemessen auf eine Vielzahl von Signalen zu reagieren.
CB2-Rezeptoren sind Teil der ‚Cannabinoid‘-Rezeptorfamilie. Sie werden so genannt, weil sie durch die Chemikalien in Cannabis ausgelöst werden können. Aber – nur damit wir uns richtig verstehen – dies ist keine Studie über Cannabis!
Eine interessante Sache an CB2-Rezeptoren ist, dass sie hauptsächlich auf Zellen des Immunsystems gefunden werden. Die Aktivierung von CB2-Rezeptoren ‚beruhigt‘ diese Immunzellen und bewirkt, dass sie weniger von ihren eigenen Signalchemikalien produzieren – den Zytokinen, die wir bereits erwähnt haben.
Wenn man das weiß und weiß, dass das Immunsystem bei der Huntington-Krankheit überaktiv ist, sollte die Aktivierung von CB2-Rezeptoren eine gute Sache sein. Andersherum betrachtet könnte die Deaktivierung von CB2-Rezeptoren bei HD schlecht sein. Muchowskis Team untersuchte beide Möglichkeiten, beginnend mit der zweiten.
Ausschalten des CB2-Gens
Das Team begann mit einem Huntington-Krankheitsmodell, den sogenannten BACHD-Mäusen, die das menschliche mutierte Huntingtin-Protein produzieren und Symptome entwickeln, die der HD ähneln. Die Symptome bei BACHD-Mäusen beginnen etwa im Alter von sechs Monaten und schreiten langsam fort.
Anschließend verwendeten sie Gentechnik, um BACHD-Mäuse herzustellen, die nicht das Gen haben, das den CB2-Rezeptor produziert. Das Entfernen eines Gens auf diese Weise wird als genetischer ‚Knockout‘ bezeichnet.
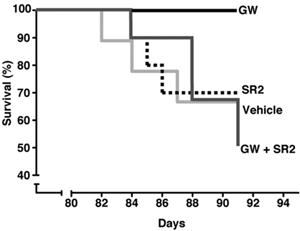
„Als die Studie nach dreizehn Wochen abgebrochen wurde, waren 30 % der unbehandelten Mäuse gestorben. Aber keine der mit GW behandelten Mäuse starb.“
Die BACHD-Mäuse ohne CB2-Rezeptoren entwickelten Symptome viel schneller als normale BACHD-Mäuse – etwa nach drei Monaten statt nach sechs.
Um zu überprüfen, ob der frühere Beginn nicht nur darauf zurückzuführen war, dass das Fehlen von CB2 schlecht für das Gehirn ist, untersuchte Muchowskis Team einen dritten Satz von Mäusen. Diesen fehlte CB2, aber sie produzierten kein mutiertes Huntingtin. Diese Mäuse schienen normal zu sein. Nur wenn beide genetischen Anomalien vorhanden waren – die Produktion von mutiertem Huntingtin und das Fehlen von CB2 – entwickelten die Mäuse sehr schnell fortschreitende Symptome.
Und es waren nicht nur die Symptome, die bei diesen Mäusen schlimmer waren. Die Forscher untersuchten den Spiegel eines Proteins namens
Aktivierung von CB2 mit einem Medikament: GW
Nachdem die Ergebnisse des CB2-Knockouts darauf hindeuteten, dass CB2-Rezeptoren etwas dazu beitragen, die Symptome bei der Huntington-Krankheit in Schach zu halten, unternahm Muchowskis Team den nächsten Schritt, indem es versuchte, die Aktivität von CB2-Rezeptoren zu erhöhen. Dazu verwendeten sie ein CB2-aktivierendes Medikament namens GW405833 oder kurz GW.
Um zu testen, ob die Aktivierung von CB2-Rezeptoren mit GW hilfreich ist, verwendeten die Forscher Huntington-Krankheitsmodellmäuse, die sogenannten R6/2-Mäuse. Diese Mäuse entwickeln sehr jung Symptome und werden schnell krank.
GW wurde R6/2-Mäusen kurz nach Beginn der Symptome, ab einem Alter von vier Wochen, regelmäßig injiziert. Ihre Bewegungssymptome wurden getestet, indem ihre Fähigkeit zum Balancieren gemessen wurde. Die mit GW behandelten Mäuse schnitten besser ab als unbehandelte Mäuse – sie konnten fast doppelt so lange auf einer rotierenden Stange balancieren.
R6/2-Mäuse sterben normalerweise nach etwa fünf Monaten, aber die GW-Behandlung führte zu etwas ganz Dramatischem. Als die Studie nach dreizehn Wochen abgebrochen wurde, waren 30 % der unbehandelten Mäuse gestorben. Aber keine der mit GW behandelten Mäuse starb. Natürlich wissen wir nicht, wie lange sie nach der Studie gelebt hätten, aber wie man es auch dreht und wendet, das ist schon bemerkenswert.
Anschließend maß Muchowskis Team den Synaptophysin-Spiegel im Gehirn. Erinnern Sie sich, dass dieser bei den CB2-Knockout-Mäusen niedriger gewesen war. Bei den mit GW behandelten Mäusen war der Synaptophysin-Spiegel höher, was darauf hindeutet, dass ein positiver Effekt von GW darin besteht, die Verbindungen zwischen den Neuronen zu verbessern.
Nachdem die frühen Behandlungsergebnisse so gut waren, wiederholten die Forscher die Studie und begannen die Behandlung einen Monat später im Alter von acht Wochen. Zu diesem Zeitpunkt waren die Mäuse bereits ziemlich krank. Aber das Medikament war immer noch vorteilhaft für Bewegungsprobleme und Gehirnverbindungen.
Blut oder Gehirn?
CB2-Rezeptoren finden sich hauptsächlich auf Immunzellen, die wiederum hauptsächlich im Blut, Knochenmark und in der Milz vorkommen. Das Gehirn hat seine eigenen Immunzellen, die sogenannten Mikroglia. Es ist also wichtig zu fragen, welche Zellen GW tatsächlich behandelt. Verbessert es die Symptome durch Mikroglia im Gehirn oder durch weiße Blutkörperchen im Körper?
Muchowskis Team wandte einen cleveren Trick an, um das herauszufinden. Einige R6/2-Mäuse erhielten zwei Medikamente. Das eine war GW, das andere war ein CB2-‚Antagonist‘ namens SR2. Ein Antagonist ist ein Medikament, das die Aktivität eines Rezeptors blockiert. SR2 und GW heben sich also gegenseitig auf, und es ist, als ob kein Medikament verabreicht wurde.
Das klingt nicht besonders clever, bis man erfährt, dass die Medikamente verschiedene Stellen im Körper erreichen. GW geht überall hin – ins Blut, in die Organe und ins Gehirn. Aber SR2 erreicht das Gehirn nicht – es bleibt im Blut und in den Organen. Da SR2 die Wirkung von GW im Körper neutralisiert, bekommen Mäuse, die mit beiden Medikamenten behandelt werden, nur die Wirkung von GW im Gehirn.

Wenn GW im Gehirn wirkt, würde man erwarten, dass sich die doppelt behandelten Tiere verbessern – aber das taten sie nicht. Sie wurden krank und starben genau wie unbehandelte Mäuse. Das deutet darauf hin, dass die Vorteile von GW durch seine Wirkung auf Immunzellen außerhalb des Gehirns zustande kommen.
Etwas Ähnliches war bereits bei Muchowskis anderem Medikament, JM6, beobachtet worden. Zusammengenommen deuten diese Ergebnisse darauf hin, dass die Veränderung des Verhaltens des Immunsystems im Körper positive Auswirkungen auf das Gehirn haben kann, was viele neue Angriffsmöglichkeiten im Kampf gegen die Huntington-Krankheit eröffnet.
Einen Schritt weiter gehen
Wie könnte GW, das auf Immunzellen wirkt, dem Gehirn zugute kommen? Eine Möglichkeit ist die Wirkung von Zytokinen – jenen Immun-Signalmolekülen, die wir bereits erwähnt haben. Erinnern Sie sich, dass Blutproben von Huntington-Krankheitspatienten höhere Spiegel dieser Zytokine aufweisen, insbesondere eines namens IL-6.
Als Muchowskis Team den IL-6-Spiegel in den mit GW behandelten Mäusen maß, stellten sie fest, dass er niedriger war – GW hatte das überaktive Immunsystem quasi ‚beruhigt‘. Also führten diese fleißigen Wissenschaftler eine weitere Medikamentenstudie durch, um IL-6 weiter zu untersuchen.
Dieses Mal gaben sie R6/2-Mäusen Injektionen mit einem Antikörperprotein, das an IL-6 bindet und dem Körper signalisiert, es zu entfernen. Mäuse, die mit diesem IL-6-reduzierenden Antikörper behandelt wurden, hatten eine bessere Bewegungskontrolle als unbehandelte Mäuse. Der Effekt war nicht so dramatisch wie bei GW, aber er war vorhanden, was darauf hindeutet, dass die Senkung von IL-6 eine Möglichkeit sein könnte, wie die Vorteile von GW das Gehirn erreichen.
Zusammenfassend
Diese Studie, die jahrelange Arbeit darstellt, gibt uns viel Stoff zum Nachdenken.
Wir wussten bereits, dass sich das Immunsystem bei HD etwas anders verhält, aber wir waren uns weniger darüber im Klaren, ob die direkte Behandlung eine gute Idee ist.
Muchowskis Studie liefert starke Beweise dafür, dass CB2-Rezeptoren eine wichtige Verbindung zwischen dem Immunsystem im Körper und der Huntington-Krankheit im Gehirn darstellen.
Das Medikament GW brachte für diese sehr kranken R6/2-Mäuse recht dramatische Vorteile, aber GW wurde noch nie an Menschen getestet, so dass viele Sicherheitstests erforderlich sein werden, um sicherzustellen, dass es nicht schädlich ist. Medikamente, die CB-Rezeptoren aktivieren, sind in einigen Ländern zugelassen (z. B. Sativex für Symptome der Multiplen Sklerose), aber es gibt keinen spezifischen CB2-Aktivator auf dem Markt.
Es ist auch erwähnenswert, dass andere Medikamente, die die R6/2-Maus verbessert haben, bisher nicht erfolgreich waren, wenn sie an Menschen getestet wurden, da kein Tier ein perfektes Modell der Huntington-Krankheit ist.
Ein interessanter Aspekt dieser Forschung ist der milde Nutzen des IL-6-Antikörpers. Interessanterweise ist ein solches Medikament bereits für die Anwendung beim Menschen bei Arthritis zugelassen – es heißt Tocilizumab (oder Actemra). Eine Humanstudie mit diesem Medikament bei der Huntington-Krankheit ist eine Möglichkeit und würde wahrscheinlich schneller in Gang kommen als eine Studie mit GW.
Schließlich – weil wir wissen, dass Sie sich immer noch fragen – kann uns diese Studie nichts Nützliches darüber sagen, ob Cannabis für Huntington-Krankheitspatienten hilfreich ist. Obwohl Cannabis CB2-aktivierende Moleküle enthält, enthält es Hunderte anderer Chemikalien, von denen viele andere biologische Wirkungen haben, die bei HD nicht getestet wurden. Obwohl wir wissen, dass Cannabis bei HD und darüber hinaus beliebt ist, können wir ihm aufgrund dieser Studie keinen wissenschaftlichen Stempel aufdrücken.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


