
Eine eindringliche Botschaft: Verursacht ein toxisches RNA-Botenmolekül Schäden bei der Huntington-Krankheit?
Was wäre, wenn einige Probleme bei der Huntington-Krankheit auf etwas anderes als ein schädliches Protein zurückzuführen wären?

Forscher haben lange geglaubt, dass das Huntington-Krankheits-Gen Probleme verursacht, indem es Zellen anweist, ein schädliches Protein herzustellen. Faszinierende neue Tierversuche von Forschern in Spanien deuten darauf hin, dass wir möglicherweise mehr als einen Verdächtigen in Betracht ziehen sollten, um die durch die HD-Mutation verursachten Probleme vollständig zu beheben.
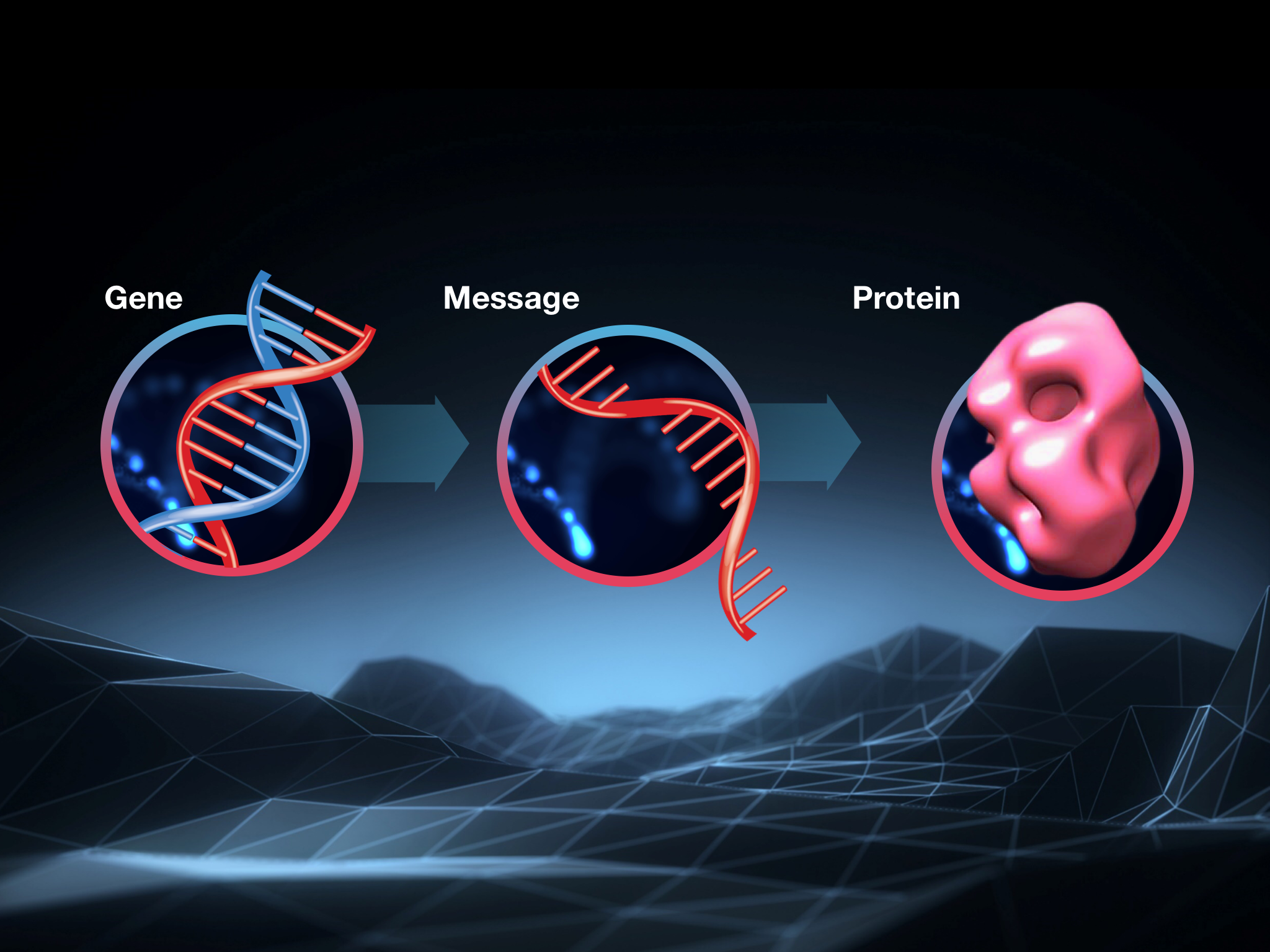
Das zentrale Dogma der Biologie
Jeder Huntington-Patient trägt die gleiche grundlegende genetische Mutation, die er entweder von seiner Mutter oder seinem Vater geerbt hat. Diese Mutation befindet sich in einem Gen, das wir meist einfach als das HD-Gen bezeichnen, um die Dinge einfach zu halten.
Die Mutation, die HD verursacht, ist eine Expansion eines bereits repetitiven DNA-Abschnitts im HD-Gen. Nahe einem Ende des Gens finden wir die genetischen Buchstaben C-A-G, die sich immer wiederholen. Bei Menschen ohne Huntington-Krankheit weisen ihre HD-Gene etwa 20 Wiederholungen dieser CAG-Sequenz auf. Wenn Sie jedoch eine Kopie des HD-Gens mit mehr als 39 Wiederholungen erben, entwickelt sich irgendwann in Ihrem Leben die Huntington-Krankheit.
Gene werden von Zellen als Anweisungen oder Rezepte verwendet, um Proteine herzustellen. Proteine sind die Maschinen, die Zellen zum Funktionieren bringen. All die coolen Dinge, die unsere Zellen tun können, hängen von der komplizierten Interaktion der Tausenden von verschiedenen Proteinen ab, die in jeder Zelle herumwirbeln.
Zwischen den Anweisungen in unseren Genen und den Proteinen, die überall in unseren Zellen Dinge tun, gibt es einen Zwischenschritt. Da DNA so wichtig ist und unter allen Umständen geschützt werden muss, kopiert die Zelle die Anweisungen in ein frisches Molekül namens RNA, wenn sie eine Kopie eines bestimmten Proteins benötigt.
Da sie Informationen von einem Ort in der Zelle zu einem anderen transportieren, bezeichnen Wissenschaftler diese Arbeitskopien als ‚Boten-RNA‘ oder mRNA.
Wann immer mRNA herumschwirrt, liest die Zelle sie und befolgt ihre Anweisungen, um das entsprechende Protein herzustellen. Diese Sequenz – Gen, mRNA, Protein – ist die Art und Weise, wie die Herstellung von Proteinen in allen Zellen erreicht und kontrolliert wird. Sie ist so grundlegend, dass sie manchmal als das ‚zentrale Dogma der Biologie‘ bezeichnet wird.
Wer ist der Bösewicht?
Welcher dieser Akteure ist der Bösewicht? Die meisten Wissenschaftler, die an HD arbeiten, glauben, dass es das mutierte Protein ist, nicht das Gen oder der Botenstoff, das die meisten Probleme in den Zellen von Menschen mit der Huntington-Krankheits-Mutation verursacht. Und es gibt eine Menge Beweise dafür, dass das Protein
Bei einigen anderen genetischen Erkrankungen ist das Botenmolekül selbst die Hauptursache für Probleme. Ein Beispiel ist eine Krankheit namens myotone Dystrophie, die ebenfalls durch zu viele Wiederholungen einer dreibuchstabigen genetischen Sequenz verursacht wird. Bei der myotonen Dystrophie führen Botenmoleküle mit langen Wiederholungen dazu, dass Zellen falsch arbeiten und schließlich absterben – die mRNA ist schuld, nicht das entsprechende Protein.
Es gibt seit langem eine Gruppe von Wissenschaftlern, die glauben, dass der Botenstoff auch bei der Huntington-Krankheit schädlich sein könnte. Neue Arbeiten einer Gruppe in Spanien deuten darauf hin, dass diese Querdenker etwas auf der Spur sein könnten.
Frühe Arbeiten in Zellen
Im Jahr 2012 beschrieb eine Gruppe von Forschern unter der Leitung von Eulalia Marti von der Universität Barcelona einige sehr interessante Arbeiten mit dem HD-Gen-Botenstoff. Sie entdeckten, dass Botenmoleküle von mutierten HD-Genen – der Art, die bei Menschen gefunden wird, die die Huntington-Krankheit entwickeln – für im Labor wachsende Zellen toxisch sein könnten. Botenmoleküle von normalen Genen waren für Zellen nicht toxisch.
Das war überraschend, weil das Team sorgfältig darauf geachtet hatte, sicherzustellen, dass die Botenmoleküle, die sie untersuchten, die Zelle nicht tatsächlich anweisen konnten, mutiertes Protein herzustellen. Sie führten auch einige detaillierte Folgeexperimente durch und identifizierten einige der Schlüsselakteure in der Zelle, die dazu führen, dass der Botenstoff toxisch ist.
Aber nur weil etwas in Zellen in einer Schale passieren kann, bedeutet das nicht, dass es in lebenden Gehirnen passiert. Deshalb wandte sich Martis Team als nächstes einem Mausmodell der Huntington-Krankheit und den Gehirnen von tatsächlichen HD-Patienten zu. In kranken Regionen der Gehirne von Mäusen und Menschen fanden sie Hinweise auf toxische Stücke des HD-Gen-Botenmoleküls. Als sie sorgfältig alle Proteine und anderen Stoffe aus diesen echten Gehirnen entfernten und nur die Botenmoleküle übrig ließen, stellten sie fest, dass diese Botenmoleküle gesunde Zellen im Labor krank machten.
Dies ist ein ziemlich guter Beweis dafür, dass etwas Interessantes mit dem Botenmolekül des HD-Gens passiert und dass es sehr gut möglich ist, dass einige der Gründe, warum Zellen bei HD krank werden, durch andere Dinge als das mutierte Protein verursacht werden könnten.
„Diese neue Studie verwendet eine clevere Methode, um zu zeigen, dass der Botenstoff schädlich sein könnte und dass dieser Schaden wichtig sein könnte.“
Neue Arbeit an Mäusen
Kürzlich hat Martis Team eine sehr interessante Folgestudie veröffentlicht, die darauf hindeutet, dass sie etwas Wichtigem auf der Spur sein könnten. Diese neue Studie verwendet eine clevere Methode, um zu zeigen, dass der Botenstoff schädlich sein könnte und dass dieser Schaden wichtig sein könnte.
Marti und ihr Team überlegten sich eine Möglichkeit, zu verhindern, dass das HD-Gen-Botenmolekül toxisch wird, ohne die Mengen des aus dem HD-Gen hergestellten Proteins zu verändern. Mit anderen Worten, der Botenstoff ist immer noch da und kann immer noch von der Protein produzierenden Maschinerie gelesen werden, aber er ist nicht mehr in der Lage, direkt Schaden anzurichten.
Überraschenderweise fanden sie einen Weg, genau dies zu tun, indem sie etwas namens Antisense-Oligonukleotid oder ASO verwendeten.
Wenn Sie bereits mit ASOs vertraut sind, liegt das wahrscheinlich daran, dass sie derzeit in menschlichen Patienten mit Huntington-Krankheit als potenzielle Therapie getestet werden. Im Allgemeinen besteht die Aufgabe von ASOs darin, in Zellen zu gelangen und an Botenmolekülen zu haften.
Die ASOs, die derzeit an Menschen getestet werden und von Ionis Pharmaceuticals hergestellt werden, haften am HD-Gen-Botenmolekül und zielen auf dessen Zerstörung ab. Weniger Botschaft bedeutet weniger Protein – und wir hoffen, dass dies die Zellen vor Schaden schützt. Der Ansatz wird als Huntingtin-Senkung oder manchmal als Gen-Stilllegung bezeichnet.
Aber die von Marti und ihren Kollegen verwendeten ASOs funktionieren auf eine subtil andere Weise. Sie gelangen in Zellen und finden das HD-Botenmolekül, aber sobald sie es gefunden haben, haften sie einfach daran und bleiben dort. Keine Zerstörung des HD-Botenstoffs und somit keine Veränderung der Mengen des aus der Botschaft verwendeten Proteins.
Warum sollten wir ein so nutzloses ASO wollen? Weil Martis Team herausfand, dass durch die Bindung an die HD-Gen-Botschaft die toxischen Wirkungen der Botschaft, die sie in ihrer früheren Studie kartiert hatten, blockiert wurden. Kurz gesagt, sie fanden ein sehr cooles Werkzeug, um die Bedeutung der Rolle zu testen, die der HD-Gen-Botenstoff spielt.
Als sie dieses spezielle ASO in die Gehirne von HD-Modellmäusen injizierten, stellten sie eine Verringerung der toxischen Botenstoffwirkungen fest, aber keine Veränderung des HD-Proteins, wie sie vorhergesagt hatten. Überraschenderweise stellten sie fest, dass die Mäuse, obwohl immer noch viel mutiertes HD-Protein vorhanden war, viel gesünder wirkten.
Was bedeutet das alles?
Dies ist wirklich coole Wissenschaft, weil sie sehr sorgfältig durchgeführt wird und uns daran erinnert, dass wir unsere Annahmen darüber, wie HD funktioniert, immer wieder hinterfragen müssen. Jedes Problem, das so komplex ist wie HD, hat wahrscheinlich mehrere Ursachen – und es ist völlig plausibel, dass sowohl der Botenstoff als auch das aus dem mutierten Gen erzeugte Protein toxisch sein könnten.
Was bedeutet dies für HD-Therapien, insbesondere für die laufende Huntingtin-Senkungsstudie mit ASOs? Wir sind uns noch nicht sicher, aber intuitiv macht es Sinn, dass ein ASO des Typs, der von Ionis getestet wird, für beide Arten von toxischen Wirkungen von Vorteil sein sollte – die durch die Botschaft und die durch das Protein verursacht werden. Viele andere Ansätze zur Huntingtin-Senkung würden voraussichtlich auch den toxischen Botenstoff und das Protein beseitigen. Und selbst wenn eine zukünftige Behandlung ’nur‘ die Mengen des Proteins reduziert, sind wir uns immer noch ziemlich sicher, dass dies eine wirklich gute Sache wäre. Das ist eine Erleichterung!
Nachdem Marti und ihr Team den Weg gewiesen haben, können Forscher in Zukunft überprüfen, wie sich jede neue vorgeschlagene Therapie auf beide möglichen Arten von Toxizität auswirkt, die durch die HD-Mutation verursacht werden.
Mehr erfahren
Quellen & Referenzen
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


