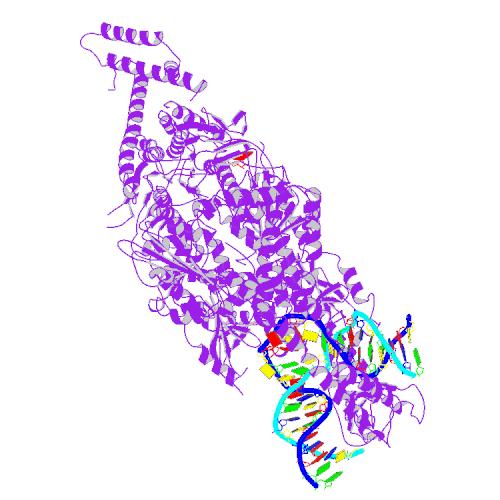
Ein DNA-Reparaturprotein verändert die Stabilität langer CAG-Sequenzen im Huntington-Krankheits-Gen
Die DNA-Reparatur ist ein kritischer Prozess für Zellen, aber Fehler in diesem Prozess könnten die ‚Repeat-Instabilität‘ bei HD erklären
Das Protein MSH3 übt eine wichtige Funktion in Zellen aus, indem es genetische Fehler und beschädigte DNA aufspürt und bei der Reparatur hilft. Eine neue Studie von Wissenschaftlern des University of Toronto, Hospital for Sick Children, deutet jedoch darauf hin, dass MSH3 das Fortschreiten der Huntington-Krankheit fördern könnte, indem es die CAG-Repeat-Instabilität im Gehirn erhöht.
Das Problem der genetischen Instabilität
Die grundlegende Ursache der Huntington-Krankheit ist gut bekannt. Ein sich wiederholendes Segment von drei Bausteinen des genetischen Codes Cytosin-Adenosin-Guanin (oder einfacher ‚C-A-G‘) in der Nähe des Beginns des HD-Gens ist bei Menschen, die die Krankheit entwickeln, übermäßig lang.
Der CAG-Repeat weist eine große Vielfalt in der gesamten Bevölkerung auf, selbst bei nicht betroffenen Personen. Normale Repeat-Längen können zwischen 6 und 36 liegen, während Repeats, die länger als 40 sind, unweigerlich zu Huntington-Krankheit führen.
Aber die CAG-Repeat-Länge hat auch andere, vorhersagende Eigenschaften. Die Anzahl der Repeats kann nicht nur bestimmen, ob eine Person an der Huntington-Krankheit erkrankt oder nicht, sondern sie kann auch ungefähr das Alter vorhersagen, in dem die Krankheitssymptome auftreten können. Je länger die Repeat-Länge, desto früher beginnt die HD im Durchschnitt.
In Familien, die die Mutation tragen, zeigt HD manchmal ‚Antizipation‘ – eine technische Art zu sagen, dass der Krankheitsbeginn mit jeder nachfolgenden Generation früher erfolgen kann. Wissenschaftler haben entdeckt, dass diese Antizipation durch ein biologisches Ereignis namens ‚genetische Instabilität‘ erklärt werden kann.
Instabilität bezieht sich auf eine Tendenz, dass repetitive DNA-Abschnitte im Laufe des Lebens eines Individuums wachsen. Dies kann beispielsweise dazu führen, dass der C-A-G-Bereich im HD-Gen länger wird.
Aus Gründen, die nicht verstanden werden, tritt genetische Instabilität in einigen Geweben und Zelltypen häufiger auf als in anderen. Während beispielsweise die Repeat-Längen im Blut recht stabil sind (wo Proben für HD-Gentests entnommen werden), dehnen sie sich in Spermien oft aus.
Diese genetische Instabilität erklärt, warum Antizipation bei HD auftritt. Repeats werden tendenziell länger, was im Durchschnitt dazu führt, dass Kinder einen früheren Beginn haben als ihre Eltern. Da diese Expansion besonders häufig in Spermien vorkommt, sind Expansionen bei HD-Genen, die von Vätern vererbt werden, wahrscheinlicher als bei Müttern.
Die generationsübergreifenden Auswirkungen der genetischen Instabilität sind seit geraumer Zeit bekannt. Neuere Studien werfen jedoch ein Licht darauf, wie sie sich auch auf die Krankheitsprognose innerhalb einzelner Patienten auswirken kann.
Instabilität im Gehirn
Hirnschäden bei der Huntington-Krankheit haben ein spezifisches Muster: Nicht alle Teile des Gehirns degenerieren im gleichen Ausmaß. Die Teile des Gehirns, die am anfälligsten für das Absterben bei HD sind, werden als Striatum und Großhirnrinde bezeichnet. Interessanterweise haben Wissenschaftler entdeckt, dass diese Hirnregionen auch die Bereiche sind, die die höchsten Grade an Repeat-Instabilität aufweisen.
Da die Repeat-Länge so eng mit dem HD-Erkrankungsalter verbunden ist, könnte die Verlängerung des CAG-Repeats innerhalb dieser Hirnregionen möglicherweise erklären, warum sie bei der Krankheit selektiv verloren gehen. Um diese Idee weiter zu untermauern, sind HD-Patienten, die die schwersten Hirnschäden aufweisen, diejenigen mit den höchsten Graden an CAG-Repeat-Instabilität.
Diese Ergebnisse werfen eine wichtige Frage auf. Warum haben einige HD-Patienten höhere Grade an genetischer Instabilität im Gehirn? Welches Problem kommt zuerst, verursacht mehr Hirnschaden eine erhöhte Instabilität, oder verursacht Instabilität schlimmere Hirnschäden?
In einem Versuch, dieses Problem direkt anzugehen, suchte ein Team unter der Leitung von Dr. Christopher Pearson am Hospital for Sick Children in Toronto nach Genen, die Unterschiede in der genetischen Instabilität von einer Person zur nächsten kontrollieren könnten. Bei dieser Suche kristallisierte sich ein Gen namens MSH3 als Hauptkandidat heraus.
„Leider ist ein Nebenprodukt des Reparaturprozesses, dass zusätzliche CAG-Repeats fälschlicherweise in die Sequenz eingefügt werden können. Wie bei einem Erdrutsch gilt: Je mehr Repeats hinzugefügt werden, desto größer wird das ursprüngliche Problem. Dies ist die Wurzel der genetischen Instabilität.“
Die Beweise
Um nach Genen zu suchen, die die genetische Instabilität kontrollieren könnten, fügten die Forscher ein kleines, aber toxisches Fragment des Huntington-Krankheits-Gens in zwei verschiedene Stämme von Mäusen ein. Verschiedene Stämme von Mäusen sind so ähnlich wie Menschen aus verschiedenen Familien oder verschiedene Hunderassen – obwohl sie alle Mäuse sind, haben sie unterschiedliche genetische Hintergründe.
Die Forscher entdeckten, dass die Huntington-Krankheits-Geninstabilität in einem Mäusestamm (B6 genannt) auftrat, aber nicht in dem anderen (CBy genannt). Aus früheren Forschungen zur genetischen Instabilität, die vom Pearson-Labor und anderen durchgeführt wurden, vermuteten die Forscher, dass der dramatische Unterschied zwischen den Mäusen auf Unterschiede in einem bestimmten biologischen Prozess, der Mismatch-Reparatur genannt wird, und insbesondere auf einen seiner Hauptakteure, das MSH3-Protein, zurückzuführen sein könnte.
Um zu testen, ob genetische Unterschiede in MSH3 die Veränderung der Repeat-Instabilität verursachen, übertrugen die Wissenschaftler das MSH3-Gen von CBy-Mäusen (die zuvor keine CAG-Repeat-Expansion zeigten) in den B6-Stamm und umgekehrt.
Die Ergebnisse waren dramatisch. Das Austauschen der Gene zwischen den Mäusestämmen verursachte eine vollständige Umkehrung der Repeat-Instabilität. Die CBy-Mäuse, die zuvor immun gegen Erhöhungen der Repeat-Länge waren, waren nun der Stamm mit den höchsten Graden, während der B6-Stamm überhaupt wenig Repeat-Instabilität zeigte. Der Effekt folgte dem MSH3-Gen!
Um festzustellen, was die Diskrepanz verursachen könnte, untersuchten die Forscher die genetischen Sequenzen des MSH3-Gens aus beiden Mäusestämmen. Innerhalb des CBy-Stamms wurde eine einzelne Mutation identifiziert, die eine signifikante Auswirkung auf die Funktion von MSH3 hatte. Diese einzelne Mutation führte dazu, dass das MSH3-Protein instabil wurde und schnell von der Zelle abgebaut wurde. Infolgedessen würde jedes von den Zellen hergestellte MSH3 schnell abgebaut und recycelt, wodurch seine Gesamtmenge erheblich reduziert würde.
Diese Ergebnisse deuteten auf zwei Dinge hin: dass eine Person, die natürlich eine ähnliche Mutation in ihrem MSH3-Gen trug, möglicherweise auch eine reduzierte CAG-Repeat-Instabilität und damit eine bessere Krankheitsprognose hätte, und zweitens, dass die Herstellung von Medikamenten zur Bekämpfung von MSH3 für die Behandlung der Huntington-Krankheit wertvoll sein könnte, vorausgesetzt, dass Instabilität wichtig ist.
Mismatch-Reparatur und das MSH3-Protein
Was genau macht MSH3 und wie könnte es die Prognose der Huntington-Krankheit beeinflussen? Um dies am besten zu erklären, müssen wir ein wenig über den zuvor erwähnten, so wichtigen biologischen Prozess der DNA-Mismatch-Reparatur lernen.
Die DNA-Reparatur im Allgemeinen ist ein notwendiger Prozess, der es unseren Zellen ermöglicht, Fehler oder Mutationen zu korrigieren, die in unserem genetischen Code auftreten. Diese Mutationen können durch mehrere Ereignisse verursacht werden, einige durch normale zelluläre Aktivitäten und einige durch Umweltschäden, wie z. B. UV-Licht oder Chemikalien. Einige genetische Schäden können Brüche in der DNA verursachen, während andere einzelne Mutationen einführen – Veränderungen in der Buchstabenfolge in der DNA.
Mismatch-Reparaturproteine wie MSH2, MSH3 und MSH6 suchen nach zwei verschiedenen Arten von genetischen Fehlern: ‚Mismatches‘, die auftreten, wenn DNA in sich teilenden Zellen kopiert wird, und kleine Schleifen, die sich innerhalb der DNA bilden können, nachdem ein einzelner Strangbruch aufgetreten ist.
CAG-Repeats, die HD verursachen, sind besonders anfällig für die Bildung dieser kleinen DNA-Schleifen. Der Grund hängt mit den grundlegenden Eigenschaften der DNA zusammen, die es ihr ermöglichen, innerhalb der Zelle kopiert zu werden.
Bildnachweis: Madeleine Price Ball
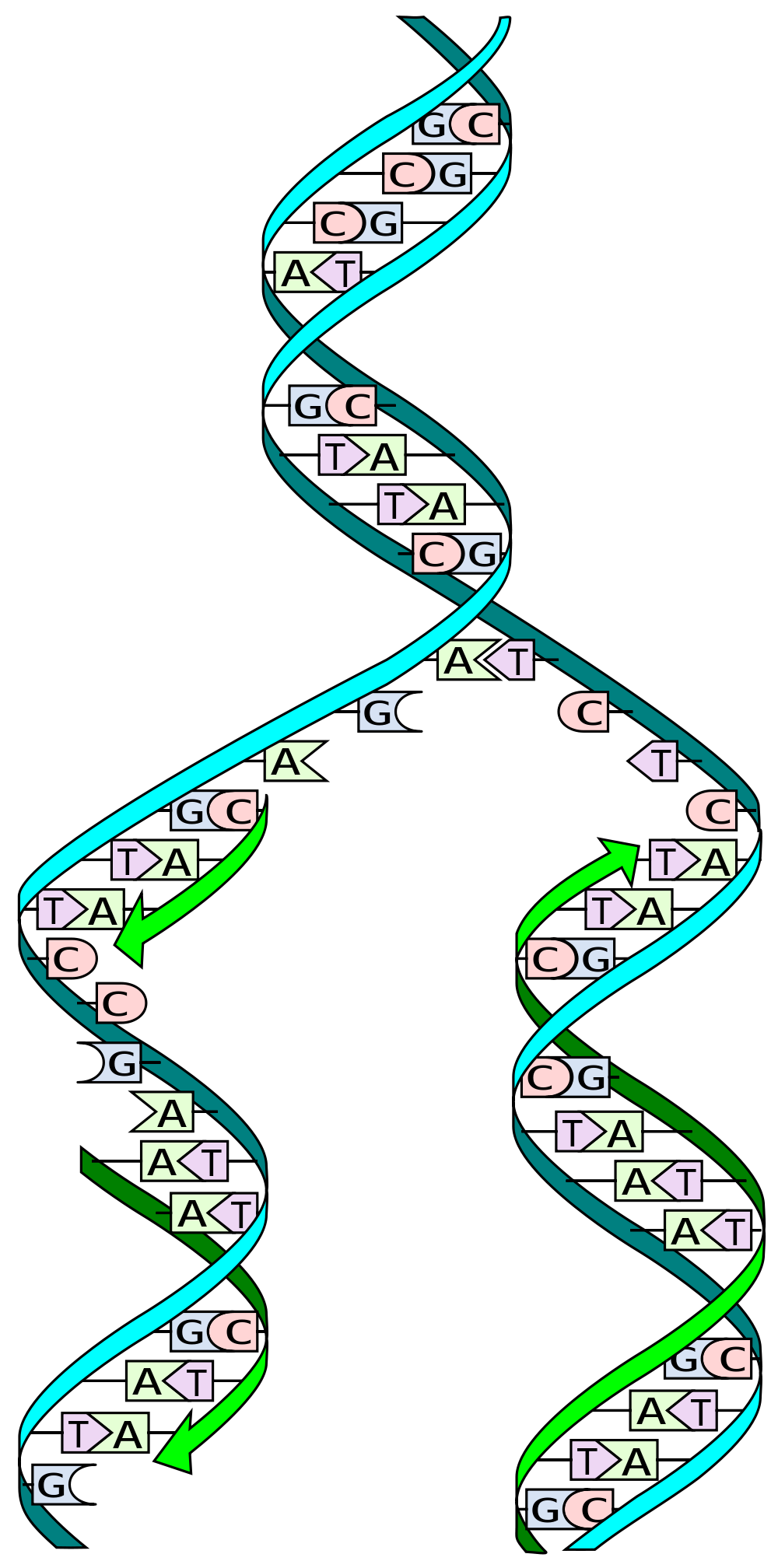
Viele Menschen haben gehört, dass DNA eine ‚Doppelhelix‘ ist. Dies bedeutet im Grunde, dass sie aus zwei Strängen besteht, die eine gewundene Struktur bilden. Diese DNA-Stränge werden oft als Kopien voneinander oder als Spiegelbild beschrieben, aber das ist nur teilweise richtig.
DNA besteht aus nur 4 verschiedenen genetischen Bausteinen, den sogenannten Nukleotiden, die Cytosin (C), Guanin (G), Adenosin (A) und Thymidin (T) genannt werden. C hat eine natürliche Affinität zu G, während A von T angezogen wird.
Wenn DNA repliziert wird, wird die Doppelhelix in zwei einzelne Stränge aufgeteilt. Spezialisierte molekulare Maschinen, sogenannte ‚Polymerasen‘, lesen dann den genetischen Code, Buchstabe für Buchstabe, und erzeugen einen neuen zweiten Strang und damit eine neue Kopie der DNA.
Um dies zu tun, nutzen die Polymerasen die natürlichen Affinitäten der Nukleotide. Wenn die Maschinerie beispielsweise ein C in der genetischen Sequenz erreicht, rekrutiert sie ein G in den wachsenden DNA-Strang, und wenn sie ein T erkennt, paart sie es mit einem A. Deshalb sagen wir, dass die beiden DNA-Stränge nicht genau eine Kopie voneinander sind. Sie liefern die Informationen, um den zweiten Strang herzustellen, aber sie sind keine exakte Nachbildung.
Kommen wir nun zurück zu den CAG-Repeats. Wenn ein DNA-Strang in der Nähe oder innerhalb eines langen CAG-Repeats bricht, kann er diesen Strang aufgrund der natürlichen Affinität von C’s und G’s innerhalb seiner Sequenz dazu bringen, eine Schleife zu bilden.
Zwei Mismatch-Reparaturproteine, MSH2 und MSH3, kommen zusammen, um diese Arten von DNA-Schleifen aufzuspüren und zu reparieren. Leider ist ein Nebenprodukt des Reparaturprozesses, dass zusätzliche CAG-Repeats fälschlicherweise in die Sequenz eingefügt werden können. Wie bei einem Erdrutsch gilt: Je mehr Repeats hinzugefügt werden, desto größer wird das ursprüngliche Problem. Dies ist die Wurzel der genetischen Instabilität.
Was genau passiert also in den CBy-Mäusen, das sie resistent gegen Repeat-Expansion macht? Erinnern Sie sich, die Forscher fanden heraus, dass die CBy-Mäuse eine Mutation in der genetischen Sequenz von MSH3 hatten, die dazu führte, dass das Protein instabil wurde. Mit weniger MSH3, das zur Verfügung steht, um DNA-Schleifen innerhalb des CAG-Repeats des HD-Gens zu finden und zu korrigieren – wodurch möglicherweise zusätzliche CAGs in den Prozess eingeführt werden – kam die genetische Instabilität zum Erliegen.
Wie geht es weiter?
Was bedeutet das alles für Huntington-Patienten? Im Moment deutet alles darauf hin, dass einer der Gründe, warum es Unterschiede im Erkrankungsalter zwischen Menschen mit gleichen Repeat-Längen gibt, in der unterschiedlichen Fähigkeit ihrer MSH3-Proteine liegen könnte, diese DNA-Schleifen zu reparieren. Wenn es Menschen gäbe, die eine ähnliche Mutation wie die in den Mäusen identifizierte trugen, könnten sie eine verzögerte Krankheitsprogression haben.
Theoretisch deutet die Studie auch darauf hin, dass wir, wenn wir die Aktivität des MSH3-Proteins bei HD-Patienten verändern könnten, die Menge der Repeat-Instabilität in ihrem HD-Gen verändern könnten. Wenn Repeat-Instabilität für die Entwicklung von HD wichtig ist, könnte dies theoretisch die Entwicklung der Krankheit verlangsamen.
Die Herausforderung bei der Bekämpfung von MSH3 besteht jedoch darin, dass die DNA-Reparatur ein wichtiger Prozess für alle Zellen im Körper ist. Wenn Mutationen in Genen nicht effizient korrigiert werden können, haben sie das Potenzial, sich anzusammeln und Krebs zu verursachen. Es bleibt abzuwarten, ob eine Störung der MSH3-Aktivität ausreichend toleriert werden könnte, um den HD-Beginn zu verhindern, ohne andere schwere Krankheiten zu verursachen.
Diese Studie macht keine Versprechungen über das therapeutische Potenzial der Forschung, aber sie hat sicherlich Interesse an der Verfolgung von MSH3 bei Patienten geweckt. Je mehr wir über verschiedene Gene wissen, die die Huntington-Krankheit beeinflussen können, desto besser können die Informationen genutzt werden, um eine verbesserte Patientenversorgung durch eine genauere Krankheitsprognose zu gewährleisten.
Mehr erfahren
Weitere Informationen zu unseren Offenlegungsrichtlinien finden Sie in unseren FAQ…


