Tauziehen mit Tau: neue Einsichten in die chemischen Grundlagen der Huntingtonkrankheit
Trägt das Tau Protein, bekannt aus anderen neurodegenerativen Erkrankungen, auch zur Huntingtonkrankheit bei?
Von Siddharth Nath 21. September 2014 Bearbeitet von Professor Ed Wild Übersetzt von Martin Oehmen Ursprünglich veröffentlicht am 13. September 2014
Wir wissen, dass eine genetische Veränderung der Grund für die Huntingtonkrankheit ist; sie resultiert in ein schadhaftes Protein: mutiertes Huntingtin. Andere Proteine können jedoch mit ins Getümmel gezogen werden und zu den Problemen beitragen, denen sich HK infizierte Zellen stellen müssen. Neue Forschungsergebnisse legen nahe, dass ein berühmt berüchtigtes Protein namens ‘Tau’ - ein bekannter Unruhestifter in anderen degenerativen Gehirnerkrankungen - an den Auswirkungen der HK beteiligt ist.
Spielt Tau eine Rolle bei der Huntington Krankheit?
Um eine wirkungsvolle Behandlungsmethode für eine Krankheit zu entwickeln, müssen wir zunächst verstehen, wie sie die normalen Abläufe im Körper behindert. Bei der Huntington Krankheit wissen wir, dass das Vorhandensein eines mutierten Gens die Zelle dazu veranlasst ein schädliches Protein zu synthetisieren, wir nennen es mutiertes Huntingtin. Diese Art des Huntingtin Proteins ist dafür bekannt sich in Klumpen anzusammeln, sogenannte Inklusionen oder Aggregate. Sie sind dafür bekannt, die Funktionsweise von Neuronen zu stören.
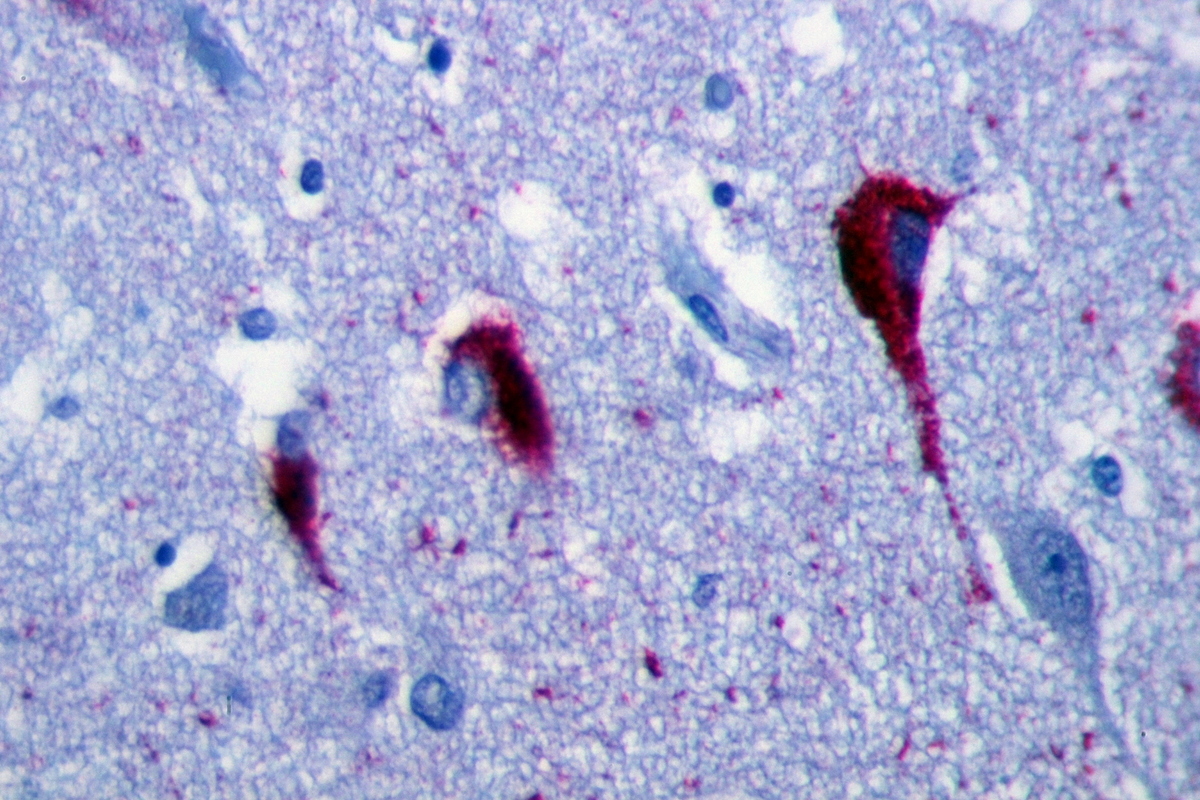
Eine Gruppe in Spanien, unter Leitung von Jose Lucas, deckte eine Verbindung zwischen dem mutierten Huntingtin Gen und einem anderen berüchtigten Protein auf, Tau.
Man findet Tau in Neuronen, hier ist es mit kleinen Strukturen assoziiert, die Mikrotubuli genannt werden. Die Mikrotubuli fungieren als “Stützpfeiler”, welche die Form der Zelle erhalten, ähnlich wie Stahlträger in einem Gebäude.
Die Gruppe um Lucas untersuchte gründlich die Gehirne von HK Patienten, die zu Forschungszwecken gespendet wurden. Sie fanden heraus, dass Tau im Zellkern von Neuronen zu stabförmigen Strukturen verklumpt, anstatt mit den Mikrotubuli assoziiert zu sein. Messungen der Gesamtmenge an Tau in den HK Gehirnen zeigten eine ungewöhnlich hohe Menge des Proteins.
Es gibt verschiedene Arten von Tau, die sich alle ähneln. Die wichtigsten werden ‘3-repeat’ und ‘4-repeat’ Tau genannt, benannt nach der Anzahl der Wiederholungen (eng.: repeats) eines bestimmten Bausteins des finalen Proteins. Dieser Baustein ist sehr wichtig, er ermöglichst erst die Bindung von Tau an die Mikrotubuli. Man kann sich vorstellen, als hätten diese beiden Tau-Varianten 3 bzw. 4 Hände, mit denen sie die Mikrotubuli festhalten.
Neben der ungewöhnlich hohen Konzentration des Tau-Proteins fand die Gruppe um Lucas zudem heraus, dass das Verhältnis der beiden Proteinvarianten verändert war: sie fanden deutlich mehr 4-repeat Tau als erwartet.
Schneiden und Spleißen
HK Gehirne besitzen also sowohl zu viel Tau als auch zu viel der 4-repeat Variante. Außerdem verklumpt das Protein zu seltsamen Stabstrukturen. Wodurch werden all diese Tau bezogenen Abweichungen hervorgerufen?
Lasst uns zuerst einen Blick darauf werfen, wie Zellen verschiedene Versionen eines Proteins herstellen.
„Dies lässt uns ‘auf den Schultern von Riesen’ stehen - wir können einen Vorteil daraus ziehen, was Forscher schon alles über Tau in der Alzheimerkrankheit und FTD aufgedeckt haben, wie es Probleme verursacht und wie es bekämpft werden kann. “
Unsere Gene ähneln einem Rezeptbuch, geschrieben in der chemischen Sprache der DNA. Es erklärt den Zellen, wie all die verschiedenen Proteine hergestellt werden, welche sie benötigen. Da diese Rezepte eine kritische Rolle bei der Funktionsfähigkeit der Zellen spielen, werden diese sicher im Nukleus verwahrt. Um ein Protein herzustellen, erstellt die Zelle zunächst eine “Arbeitskopie” des Rezeptes, aus einem DNA ähnlichen Molekül, das mRNA genannt wird.
So wie gewöhnliche Rezepte optionale Zutaten oder Variationen enthalten, beinhalten viele Gene “optionale” Informationen, die für die Produktion des Proteins nicht von direkter Bedeutung sind.
Unsere Zellen dursuchen die mRNA somit zunächst nach Informationen, die für die angestrebte Variante des Proteins nicht von Bedeutung sind.
Diese Prozessierung der mRNA wird durch eine Gruppe von Proteinen ermöglicht, die Spleißfaktoren heißen. Sie schneiden die ungewünschten Bereiche der mRNA hinaus und lassen diejenigen übrig, die zur Synthese des Proteins benötigt werden.
Im Fall von Tau enthält das genetische Rezept sowohl die Anweisungen zur Herstellung von 3-repeat als auch 4-repeat Tau. Welche Variante erzeugt wird, ist abhängig von einem Spleißfaktor namens SRSF6. Wird dieser Faktor involviert, so wird die mRNA in einer Weise geschnitten, dass die Zelle die 4-repeat Variante von Tau produziert.
Aufgrund der ungewöhnlich hohen Menge an 4-repeat Tau in den Gehirnen von HK Patienten, fragten sich die Wissenschaftler um Lucas, ob SRSF6 in der HK aktiver ist. Sie fanden in der Tat erhöhte Werte an SRSF6 in HK Neuronen. Darüber hinaus schien SRSF6 mit in den Klumpen des mutierten Huntingtin zu stecken. Es scheint eine Affinität zwischen dem Spleißfaktor und etwas in dem Protein Aggregat zu geben. Ein Kandidat ist die mRNA des mutierten Huntingtin Proteins, da kürzlich gezeigt wurde, dass SRSF6 daran haftet.
Weiterhin wiesen sie ein ähnliches Missverhältnis von 3-repeat zu 4-repeat Tau in den Gehirnen von Ratten mit der HK Mutation nach. Nachdem diese HK Mäuse durch genetische Manipulation weniger Tau produzierten, waren einige ihrer gewöhnlichen HK ähnlichen Bewegungsstörungen weniger stark ausgeprägt.
Viele Fliegen mit einer Klatsche erschlagen

Zusammenfassend lässt sich also sagen, dass das mutierte Huntingtin Gen eine mutierte Huntingtin mRNA erzeugt, an die sich wiederum SRSF6 anlagert. Das erhöhte Level an SRSF6 verändert wiederum das Gleichgewicht einer mRNA für ein anderes Protein, Tau. Dies führt zu einer Überproduktion der 4-repeat Variante von Tau. Das 4-repeat Protein verklumpt nun zu stabförmigen Strukturen, die einen Anteil an den Problemen in HK Gehirnen haben könnten.
Warum ist diese Arbeit so wichtig? Warum ist es von Interesse, dass sich diese Tau Strukturen in den Neuronen bilden?
Tau hat eine gewisse Reputation. Es steht mit anderen ‘degenerativen’ Gehirnerkrankungen in Verbindung, wie zum Beispiel der Alzheimerkrankheit und frontotemporaler Demenz (FTD), sowie vielen weiteren.
In einer Form der FTD genügt die Anwesenheit von zu viel 4-repeat Tau gegenüber 3-repeat, um Neurodegeneration zu verursachen. Das hört sich doch sehr bekannt an! Das ist genau das, was die spanischen Wissenschaftler in Gehirnen gesehen haben, die von der HK betroffen waren.
In der Alzheimerkrankheit bildet Tau Strukturen, die ‘Neurofibrillenbündel’ genannt werden. Es sind ebenfalls große Strukturen aus Tau Proteinen, die Neurone schädigen.
Die Erkenntnis, dass Tau in der HK eine Rolle spielen könnte, könnte sich als sehr nützlich erweisen. Sie lässt uns ‘auf den Schultern von Riesen’ stehen - wir können einen Vorteil daraus ziehen, was Forscher schon alles über Tau in der Alzheimerkrankheit und FTD aufgedeckt haben, wie es Probleme verursacht und wie es bekämpft werden kann.
Bedeutet das jetzt, dass die Huntington Krankheit eigentlich ein Tau Problem ist, oder eine ‘Tauopathie’, wie Wissenschaftler Erkrankungen nennen, für die Tau sich verantwortlich zeigt? Nicht wirklich - wir können mit Sicherheit sagen, dass die Huntington Krankheit durch das mutierte Huntingtin Gen verursacht wird. Es macht zwar den Anschein, dass Tau in die Huntingtonkrankheit mit verwickelt ist, aber es kann mit Sicherheit nicht für alle Probleme verantwortlich gemacht werden, welche die Mutation verursacht.
Diese neue Krankheitsverknüpfung gibt uns einen faszinierenden neuen Betrachtungswinkel der Huntingtonkrankheit und wie sie zu behandeln ist. Und dank der vielen Verknüpfungen innerhalb der Wissenschaft haben wir schon eine Vorstellung davon was passiert, wenn Tau mit ins Boot geholt wird.


