Begegne dem Feind: Neutronenstrahlen enthüllen die HD-Proteinstruktur
Wissenschaftler benützen Neutronenstrahlen, um die Struktur von verklumptem Huntingtinprotein zu entschlüsseln
 Von Dr Jeff Carroll 10. Juli 2011 Übersetzt von Dr Dagmar Ehrnhoefer Bearbeitet von Professor Ed Wild Ursprünglich veröffentlicht am 26. Mai 2011
Von Dr Jeff Carroll 10. Juli 2011 Übersetzt von Dr Dagmar Ehrnhoefer Bearbeitet von Professor Ed Wild Ursprünglich veröffentlicht am 26. Mai 2011
Das mutierte Huntingtinprotein bildet Klumpen, oder Aggregate, in Gehirnzellen. Viele Wissenschaftler glauben, dass diese Klumpen zur Entstehung von HD-Symptomen und zum Tod dieser Zellen beitragen. Wissenschaftler haben nun einen Neutronenstrahl verwendet, um die frühesten Strukturen, die in diesen Aggregaten vorkommen, zu studieren.
Chorea Huntington, Huntington'sche Krankheit, Huntingtin…
Die Wörter, die HD beschreiben, können verwirrend sein. HD wird durch eine Mutation in dem Gen hervorgerufen, das verwirrenderweise ‘Huntingtin’ heisst. Gene werden in Zellen als Vorlagen benutzt, um Proteine herzustellen. Proteine werden sowohl als Strukturelemente in Ihren Körperzellen verwendet, als auch als Bestandteile kleiner Maschinen, die die meiste Arbeit in den Zellen erledigen.
Das Huntingtin-Gen ist die Vorlage für das Huntingtin-Protein. Das Huntingtin Protein verursacht HD, nicht die Genmutation alleine. Die grundlegende Aufgabe von Wissenschaftlern, die heute an HD arbeiten, ist es, herauszufinden, wie das mutierte Huntingtin Protein HD Symptome hervorruft.
Aggregate im Gehirn
Im Jahr 1997 haben zwei Gruppen von Wissenschaftlern Beweise dafür gefunden, dass das Huntingtin Protein die Tendenz besitzt, sich zu verkleben und Proteinklumpen zu bilden. Ein Team um Dr Erich Wanker in Berlin hat herausgefunden, dass aufgereinigtes Huntingtin Protein im Reagenzglas Klumpen (oder Aggregate) bildet. Interessanterweise fand dies nur statt, wenn das Huntingtin Protein mutiert war, wie es im Krankheitsfall passiert.
Zur gleichen Zeit beschrieb eine Gruppe am Massachusetts General Hospital in Boston unter der Leitung von Dr Marian DiFiglia und Dr Neil Aronin sehr ähnliche Aggregate, die sie in den Gehirnen von menschlichen Patienten gefunden hatten, die an HD verstorben waren- dies legte nahe, dass der Verklumpungsprozess relevant für die Krankheit sein könnte.
In den 14 Jahren, die seit diesen bahnbrechenden Entdeckungen vergangen sind, wurde unter Wissenschaftlern viel darüber diskutiert, was diese Aggregate bei HD bewirken. Und nicht nur bei HD- Proteinklumpen können auch bei Patienten beobachtet werden, die an anderen neurodegenerativen Erkrankungen wie der Alzheimer'schen oder der Parkinson'schen Krankheit leiden.
Manche Wissenschaftler glauben, dass diese Aggregate nur Nebenprodukte der absterbenden Gehirnzellen darstellen. Andere glauben, dass die Aggregate selbst Gehirnzellen töten und die Krankheit verursachen- und sie es daher wert sind, genauestens erforscht zu werden. Diese Wisenschaftler glauben, dass das Verständnis über den ersten Schritt des Aggregationsprozesses Erkenntnisse darüber liefern wird, wie das mutierte Huntingtin Protein Zellen abtötet.
Ein Neutronenstrahl? Im Ernst?
„Diese Art von Experimenten ist nützlich zur Beilegung wissenschaftlicher Diskussionen über die Natur der Huntingtinaggregation, aber zwischen diesen grundlegenden wissenschaftlichen Beobachtungen und der Entwicklung neuer Therapien für HD liegt ein langer Weg. “
Es ist äusserst schwierig, den Aggregationsprozess von Huntingtin zu untersuchen, da einzelne Proteinmoleküle sehr klein sind. Sie sind so klein, dass herkömmliche Mikroskope nicht genug Vergrösserungswirkung besitzen, um sie sichtbar zu machen.
Hier kommen die Neutronen ins Spiel. Neutronen sind winzige, subatomare Teilchen, die normalerweise in der Mitte von Atomen vorkommen- sie gehören zu den kleinsten Bausteinen der Materie. Neutronenstrahlen können durch bestimmte Kernreaktionen produziert werden, und diese Strahlen können durch eine Probe geleitet werden. Das Material der Probe wird den Strahl ablenken- ein bisschen wie Wasser in einem Glas das Licht einer Taschenlampe ablenken kann.
Indem sie die Ablenkungsmuster untersuchen, können Wissenschaftler berechnen, wie das Material aussieht. Man könnte es mit dem Versuch vergleichen, die Form einer Person anhand ihres Schattens festzustellen. Diese Methode ist hilfreich, weil Neutronenstrahlen sehr detaillierte Schatten von sehr kleinen Objekten-wie Proteinen- erzeugen können.
Aber Neutronenstrahlen, die durch eine Kernreaktion erzeugt wurden, sind nicht gerade einfach aufzutreiben- wie können sie also für die HD-Forschung eingesetzt werden? Ein Team rund um Dr Valerie Berthelier bekam Zugriff auf die Neutronenstrahlquelle am Oak Ridge National Laboratory in Tennessee. Es ist der stärkste Neutronenstrahl der Vereinigten Staaten.
Um die HD Aggregation im Detail studieren zu können, erzeugte Berthelier’s Team viele kleine Stücke des Huntingtin Proteins- Stücke, die die krankheitsverursachende Mutation enthielten. Dieses aufgereinigte Huntingtin Protein wurde in den Strahlengang des Neutronenstrahls gelegt, und der Aggregationsprozess wurde in Echtzeit mitverfolgt.
Wie geht Aggregation nun also vor sich?
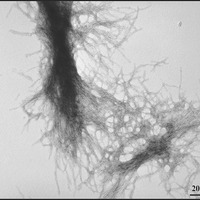
Berthelier’s Team zeigte, dass aufgereinigtes Huntingtin Protein sehr schnell verklumpt, wie es auch andere Wissenschaftler bereits beobachtet hatten. Innerhalb weniger Stunden war alles Protein in klumpigen Aggregaten verbunden. Dann verwendeten sie eine andere Methode- genannt Elektronenmikroskopie- um die Aggregate zu untersuchen, die, wie erwartet, fibrillär aussahen- ein bisschen wie Seilstränge.

Der Vorteil der Neutronenmethode ist, dass man Aggregate schon ab einer sehr kleinen Größe verfolgen kann. Die Wissenschaftler schätzen, dass zwei oder drei einzelne Huntingtin Proteine zusammenklumpen, und eine kleine Kugel formen. Diese Kugeln wuchsen schnell zu langen Seilen heran, die aus zusammengedrehten Strängen von Huntingtin Proteinen bestanden.
Einschränkungen und Schlussfolgerungen
Das Huntingtin Protein ist sehr gross- es ist mehr als sechsmal so gross wie ein durchschnittliches Protein in der menschlichen Zelle. Dadurch ist es schwierig zu untersuchen, denn grosse Proteine sind im Labor schwer handzuhaben.
Wegen dieser Schwierigkeiten arbeiten viele Wissenschaftler an kleinen Teilen des gesamten Huntingtin Proteins. Die Experimente, die hier beschrieben wurden, bedienten sich eines kleinen Fragments, das nur ungefähr die ersten 1% des Huntingtin Proteins ausmacht. Wenn man an einem solchen Fragment arbeitet, ignoriert man automatisch kompliziertere Vorgänge, die in Zellen stattfinden, wenn das gesamte Protein gemeinsam mit vielen anderen Proteinen vorhanden ist.
Ausserdem, weil diese Messungen so schwierig sind, benötigt man eine sehr grosse Menge an Huntingtin Protein- viel mehr als man normalerweise in Zellen vorfinden würde. Es ist daher unklar, ob die Beobachtungen dieser Studie mit den Vorgängen in Zellen übereinstimmen, wenn viel weniger Huntingtin vorhanden ist.
Diese Experimente sind sehr nützlich, um wissenschaftliche Debatten über die Natur der Huntingtinaggregation zu schlichten, und es ist spannend, weit entwickelte Technologien wie diese für die HD-Forschung zu verwenden. Wegen der beschriebenen Einschränkungen ist es jedoch noch ein weiter Weg, um von diesen grundlegenden wissenschaftlichen Beobachtungen zu neuen Therapien für HD zu gelangen.